MRONJのポジションペーパー2022(英日両記ver)

AAOMSのポジションペーパーが2022に改訂
MRONJ(薬剤関連顎骨壊死)のポジションペーパーですが、今年改訂されました。ダウンロードフリーです。
American Association of Oral and Maxillofacial Surgeons’ Position Paper on Medication-Related Osteonecrosis of the Jaws-2022 Update
Salvatore L Ruggiero , Thomas B Dodson , Tara Aghaloo , Eric R Carlson , Brent B Ward , Deepak Kademani
J Oral Maxillofac Surg. 2022 May;80(5):920-943. doi: 10.1016/j.joms.2022.02.008. Epub 2022 Feb 21.
https://www.joms.org/action/showPdf?pii=S0278-2391%2822%2900148-3
abstract
Strategies for management of patients with, or at risk for, medication-related osteonecrosis of the jaws (MRONJ) – formerly referred to as bisphosphonate-related osteonecrosis of the jaws (BRONJ)-were set forth in the American Association of Oral and Maxillofacial Surgeons (AAOMS) position papers in 2007, 2009 and 2014. The position papers were developed by a committee appointed by the AAOMS Board of Trustees and comprising clinicians with extensive experience in caring for these patients, as well as clinical and basic science researchers. The knowledge base and experience in addressing MRONJ continues to evolve and expand, necessitating modifications and refinements to the previous position papers. Three members of the AAOMS Committee on Oral, Head, and Neck Oncologic and Reconstructive Surgery (COHNORS) and three authors of the 2014 position paper were appointed to serve as a working group to analyze the current literature and revise the guidance as indicated to reflect current knowledge in this field. This update contains revisions to diagnosis and management strategies and highlights the current research status. AAOMS maintains that it is vitally important for this information to be disseminated to other relevant healthcare professionals and organizations.
AAOMSでは、MRONJ、以前はBRONJと呼ばれていたものの管理やリスクについての方策を過去2007、2009、2014とアップデートし、今回で4回目となりました。このポジションペーパーは、AAOMS理事会が任命し、これらの患者のケアに豊富な経験を持つ臨床医と臨床および基礎科学の研究者からなる委員会によって作成されました。MRONJに関する知識や経験は常に進歩しつづけており、以前のポジションペーパーを改訂する必要が出てきました。COHNORSのメンバー3名と14年のポジションペーパーの著者3名をワーキンググループに任命し、現在の文献を分析し、この分野の最新の知見を反映するために指示通りに指針を改訂することにした。今回のアップデートは診断や管理方法の改訂と現在の研究のハイライトを含んでいます。AAOMはこの情報を非常に重要なものとして他の医療のプロフェッショナルや機関に引き続き広めていきます。
ここからは緒言以外の全文を訳していきます。かなり文章が難しく訳の間違い等もあるかもしれません。原文を併記して確認出来るようにしておりますので、後はご自身で判断をお願いします。もし、訳が大きく間違っているようならコメント欄にご指摘いただければ幸いです。ちなみにここから英語日本語あわせて8万字ありますので、できれば大きな画面で閲覧することをお勧めします。
Purpose(目的)
The purpose of this position paper is to provide updates regarding:
- Risk estimates for developing MRONJ.
- Comparisons of the risks and benefits of medications related to osteonecrosis of the jaw in order to facilitate medical decision-making for the treating physician, dentist, dental specialist, and patient with the establishment of algorithms.
- Guidance to clinicians regarding:
a. The differential diagnosis of MRONJ in patients with a history of exposure to antiresorptive medications.
b. MRONJ prevention measures and management strategies for patients with MRONJ based on the disease stage.
このポジションペーパーの目的は以下の内容に関するアップデートを提供することです。
1 MRONJの発症のリスク
2 医療従事者や患者が医学的な意思決定を容易にするためのMRONJのリスクとベネフィットの比較
3 臨床家へのガイド
a 抗骨吸収薬を投薬された履歴がある患者のMRONJの鑑別診断
b MORNJの予防策とステージに基づいたMRONJ患者の管理方法
Medication(薬剤)
Bisphosphonates (BPs) are antiresorptive medications that are effective in managing cancer-related conditions, including hypercalcemia of malignancy, spinal cord compression, and pathologic fractures (skeletalrelated events [SREs]) associated with bone metastases in the context of solid tumors (such as breast, prostate, and lung cancers) and multiple myeloma. While the potential for BPs to improve cancer-specific survival remains controversial, these medications have had a significant positive effect on the quality of life for patients with advanced cancer involving the skeleton and reducing or preventing skeletal-related events.
Bisphosphonates also are used for the prevention of osteoporosis-related fractures (fragility fractures) in patients with osteoporosis and osteopenia. BPs administered orally–including alendronate (Fosamax ), risedronate (Actonel) or parenterally (zoledronic acid [Reclast]), and ibandronate (Boniva)—can result in a significant reduction in vertebral and nonvertebral fractures for patients with osteoporosis.
Bisphosphonate therapy also is indicated for other metabolic bone diseases such as Paget’s disease of bone and osteogenesis imperfecta. However, clinical trials have not demonstrated the efficacy of bisphosphonate therapy in the management of fibrous dysplasia.
Denosumab (DMB), a receptor activator of nuclear factor kappa-B ligand (RANK-L), is an antiresorptive agent that exists as a fully humanized antibody against RANK ligand and inhibits osteoclast function and associated bone resorption. When denosumab (Prolia) is administered subcutaneously every 6 months, there is a significant reduction in the risk of vertebral, nonvertebral, and hip fractures in osteoporotic patients. Denosumab (Xgeva) also is effective in reducing SREs related to metastatic bone disease from solid tumors when administered monthly.
RANK ligand inhibitors also have proven efficacy in the treatment of giant cell tumors of bone and fibrous dysplasia. In contrast to BPs, RANK-L inhibitors do not bind to bone, and their effects on bone remodeling are mostly diminished within 6 months of treatment cessation.
Romosozumab is a new monoclonal antibody used for fracture prevention in osteoporotic women. Romosozumab, administered subcutaneously, works via the Wnt pathway by binding to and inhibiting sclerostin, resulting in increased bone formation and decreased bone resorption.
BP製剤は骨吸収抑制剤で、骨転移による高カルシウム血症や脊椎圧迫、病的骨折などの癌関連状態に効果的です。BP製剤が癌の生存率を改善するかどうかについては議論の余地がある一方で、進行癌を患う患者さんのQOLや骨関連事象の減少や予防に大きな効果があることは確かです。
BP製剤は、骨粗鬆症、骨減少症患者の骨粗鬆症関連骨折(疲労骨折)の予防にも使用されています。経口投与のアレンドロン酸(フォサマック)、リセドロン酸(アクトネル)、非経口投与のゾレドロン酸(リクラスト)、イバンドロン酸(ボンビバ)などのBP製剤により骨粗鬆症患者の脊椎、非脊椎骨折は有意に減少します。
BP製剤による治療はページェット病や骨形成不全症などの骨代謝疾患にも適応があります。しかし、線維性骨異形成症への治療効果はまだ実証されていません。
デノスマブはRANKリガンドに対するヒトモノクローナル抗体で、破骨細胞の機能と関連する骨吸収を抑制する骨吸収抑制薬です。デノスマブ(プラリア)は6か月毎の投薬で骨粗鬆症患者の脊椎、非脊椎、臀部骨折リスクを有意に低下します。デノスマブ(XGEVA)も毎月投与で腫瘍からの代謝性骨疾患による骨吸収を抑制します。
RANKリガンド阻害薬は骨の巨細胞腫や線維性骨異形成症などの治療効果も認められています。BPとは異なり、RANK-L阻害剤は骨に結合せず、骨リモデリングに対する効果は投与中止後6ヶ月以内にほとんど減少します。
ロモソズマブは骨粗鬆症の女性の骨折防止に使用される新しいモノクローナル抗体です。ロモソズマブは皮下注で、スクレロスチンへの結合と抑制によりWntシグナル経路に作用し、骨形成の増加と骨吸収の抑制が起こります。
MRONJ Case Definition(MRONJの定義)
MRONJ should be distinguished from other forms of osteonecrosis (ONJ) conditions and identified by history and clinical exam. The clinical criteria required to establish a diagnosis of MRONJ have remained unchanged from the previous position paper. The case definition of MRONJ includes all the following elements:
- Current or previous treatment with antiresorptive therapy alone or in combination with immune modulators or antiangiogenic medications.
- Exposed bone or bone that can be probed through an intraoral or extraoral fistula(e) in the maxillofacial region that has persisted for more than 8 weeks.
- No history of radiation therapy to the jaws or metastatic disease to the jaws.
MRONJは他の骨壊死と鑑別され、現病歴や臨床的な診査により確認される必要があります。MRONJ診断を構築する基準は前回のポジションペーパーから変わっていません。MRONJの定義は以下の様になります。
1 骨吸収抑制療法単独、またはそれに合わせて免疫療法、抗血管新生療法を併用した事がある。
2 骨露出、または口腔内、口腔外の瘻孔から骨をプロービングできる状況が8週間以上継続している。
3 顎骨への放射線療法や代謝性疾患の既往がない。
Staging(ステージ分類)
A staging system for MRONJ was introduced in the 2009 AAOMS position paper and then modified in the 2014 position paper to characterize more accurately all aspects of the clinical presentation of MRONJ. Since these modifications, the AAOMS staging system has continued to be a straightforward and relevant system to properly stratify these patients. It has been adopted by several professional societies and research organizations. The staging system facilitates the creation of rational treatment guidelines and guides data collection to assess the prognosis and outcomes for MRONJ patients. While AAOMS recognizes that different classification systems are being used by other organizations, the Association considers the AAOMS system to be a useful and widely implemented assessment tool guiding clinicians involved in the care of MRONJ patients. AAOMS remains concerned that overemphasizing variable radiographic features often attributed to MRONJ may overestimate the true disease frequency by including false positives in the numerator (eg, cases with radiographic findings suggestive of MRONJ), but these patients do not fit the criteria for the diagnosis of MRONJ. In the orthopedic literature, the usefulness of a Stage 0 category has been established for staging avascular necrosis (AVN) of the femoral head when there is a suspicion of AVN in a patient at risk, but the diagnostic information is not conclusive. AAOMS believes the Stage 0 category for MRONJ is analogous in principle and does account for the wide-ranging radiographic presentation of MRONJ that exists prior to overt bone exposure. Therefore, AAOMS has decided to maintain the current classification system with no modifications.
MRONJのステージ分類については2009年のポジションペーパーで紹介され、2014年に修正されました。これらの修正以来、AAOMSステージングシステムは、これらの患者を適切にステージ分類するためのわかりやすく適切なシステムであり続けています。ステージ分類は様々な学会や組織に採用されています。このステージ分けは合理的な治療ガイドラインの構築を容易にし、MRONJ患者の予後とアウトカム調査のデータ収集をガイドします。違う分類があることをAAOMSは認識していますが、AAOMSシステムは有益で広く受け入れられていると考えています。MRONJにしばしば起因する放射線画像の特徴を強調しすぎると、MRONJの診断基準に合致しない偽陽性(例えば、MRONJを示唆する放射線所見を有する症例)を分子に含むことによって真の疾患頻度を過大評価する可能性があることを懸念しています。整形外科の文献によると、大腿骨頭の血管壊死(AVN)が疑われるが、診断情報が決定的でない場合の病期分類として、ステージ0の有用性が確立されています。MRONJのステージ0分類は原理的に類似しており、明らかな骨露出の前に存在するMRONJの広範なX線所見を考慮していると考えています。従って、AAOMSは、現在の分類システムを修正することなく維持することを決定しました。
PATIENTS AT-RISK(リスクあり)
No apparent necrotic bone in asymptomatic patients who have been treated with IV or oral antiresorptive
therapy.
骨壊死の徴候はない、骨吸収抑制療法を受けている患者
STAGE 0 (NONEXPOSED BONE VARIANT)
Patients with no clinical evidence of necrotic bone but who present with nonspecific symptoms or clinical and radiographic findings, such as:
Symptoms
・ Odontalgia not explained by an odontogenic cause.
・ Dull, aching bone pain in the jaw, which may radiate to the temporomandibular joint region.
・ Sinus pain, which may be associated with inflammation and thickening of the maxillary sinus wall.
・ Altered neurosensory function.
Clinical Findings
・ Loosening of teeth not explained by chronic periodontal disease.
・ Intraoral or extraoral swelling.
Radiographic Findings
・ Alveolar bone loss or resorption not attributable to chronic periodontal disease.
・ Changes to trabecular pattern sclerotic bone and no new bone in extraction sockets.
・ Regions of osteosclerosis involving the alveolar bone and/or the surrounding basilar bone.
・ Thickening/obscuring of periodontal ligament (thickening of the lamina dura, sclerosis, and decreased size of the periodontal ligament space).
These nonspecific findings, which characterize this variant of MRONJ without bone exposure, may occur in patients with a prior history of Stage 1, 2, or 3 disease who have been healed and have no clinical evidence of exposed bone. Progression to Stage 1 disease has been reported in up to 50 percent of patients with Stage 0 disease and, therefore, AAOMS deems it prudent to consider Stage 0 disease as a potential precursor to MRONJ.
骨壊死を起こしている確たる証拠はないが、以下の様な非特異的な徴候または臨床的、放射線所見を有している者
徴候
・歯が原因と説明出来ない歯または周囲の痛み
・顎関節部にまで放散する可能性がある鈍い歯槽骨の痛み
・炎症または上顎洞壁の肥厚に関連する可能性がある副鼻腔の痛み
・神経感覚機能の変化
臨床的な所見
・慢性歯周炎では説明出来ない歯の動揺
・口腔内または口腔外の腫脹
放射線的所見
・慢性歯周病に起因しない歯槽骨の喪失または吸収
・骨の硬化小柱パターンの変化と抜歯後の新生骨の喪失
・顎骨および、またはその周囲の基底骨を含む骨硬化の領域
・歯根膜の肥厚、不明瞭化(歯根膜の肥厚、硬化、歯根膜腔の縮小)
これらの非特異的な所見は、骨露出を伴わないMRONJの多様性を特徴づけるものであり、Stage1、2、3の病歴を持ち、治癒して骨露出の臨床的証拠がない患者にも起こり得ます。Stage 0の患者の50%がStage 1に進行することが報告されており、AAOMSはStage 0の患者をMRONJの前駆症状とみなすことが賢明であると考えています。
STAGE 1
Exposed and necrotic bone or fistula that probes to the bone in patients who are asymptomatic and have no evidence of infection/inflammation. These patients also may present with radiographic findings mentioned for Stage 0 that are localized to the alveolar bone region.
無症状で炎症や感染の証拠がない患者において壊死骨の露出または瘻孔から骨をプロービング可能という状況です。これらの患者には歯槽骨に限局したステージ0相当の放射線所見が観察されるかもしれません。
STAGE 2
Exposed and necrotic bone, or fistula that probes to the bone, with evidence of infection/inflammation. These patients are symptomatic. These patients also may present with radiographic findings mentioned for Stage 0 localized to the alveolar bone region.
炎症や感染の確証があり壊死骨の露出または瘻孔から骨をプロービング可能という状況です。患者は有症状です。これらの患者には歯槽骨に限局したステージ0相当の放射線所見が観察されるかもしれません。
STAGE 3
Exposed and necrotic bone or fistulae that probes to the bone, with evidence of infection, and one or more of the following:
・Exposed necrotic bone extending beyond the region of alveolar bone (ie, inferior border and ramus in the mandible, maxillary sinus, and zygoma in the maxilla)
・Pathologic fracture.
・Extraoral fistula.
・Oral antral/oral-nasal communication.
・Osteolysis extending to the inferior border of the mandible or sinus floor.
壊死骨の露出または瘻孔から骨をプロービング可能で感染所見にプラスして以下の所見が1つ以上認められます。
・歯槽骨を越えた領域(下顎骨下縁、下顎枝、上顎洞、頬骨など)まで及ぶ骨壊死
・病的骨折
・口腔外瘻孔
・口腔前庭/口腔ー鼻腔の交通
・下顎下縁、上顎洞底を越える骨の溶解
CAUSALITY(因果関係)
It is important to understand that patients at risk for or with established MRONJ also can present with other common clinical conditions not to be confused with MRONJ. Commonly misdiagnosed conditions may include but are not limited to alveolar osteitis, sinusitis, gingivitis/periodontitis, caries, periapical pathology, odontalgia, atypical neuralgias, fibro-osseous lesions, sarcoma, chronic sclerosing osteomyelitis, and temporomandibular joint (TMJ) disorders. It also is important to remember that delayed healing, exposed bone or sequestra (ie, osteonecrosis [ONJ]), can occur in patients not exposed to antiresorptive agents.
Proving causality of any medication-related complication is challenging from an epidemiologic perspective. It is well-known that MRONJ is a rare entity, multifactorial in nature, and patients with the same clinical presentation exist who have not been exposed to an antiresorptive medication. Studies have reported jaw necrosis in antiresorptive na€ıve patients in which necrosis was linked to bacterial, viral, or fungal infections, trauma, smoking, steroids, immunocompromised host, autoimmune diseases, diabetes, and chemotherapy. Furthermore, patient populations, such as those with osteogenesis imperfecta have been treated with antiresorptive agents without reports of MRONJ. Many patients receiving medications associated with MRONJ have other comorbidities, which are likely exacerbating or contributing factors. In combination, these confounding variables make incidence and prevalence difficult to estimate.
Clinical trials, while being the gold standard for efficacy and safety data, are seldom powered to demonstrate uncommon events. Prior to the discovery of MRONJ, large randomized prospective trials of BPs with up to 10 years of patient data did not reveal any jaw bone necrosis as a complication. More recently, the HORIZON Pivotal Fracture trial tested 3,889 randomized patients given annual zoledronic acid versus placebo for 3 years; one patient developed MRONJ in the intervention group and one in the placebo group. Extension of this trial for up to 6 years resulted in one additional MRONJ patient in the treatment group. Extension to 9 years resulted in no additional confirmed cases of MRONJ.
Definitive causality, taken as a whole, remains a difficult task to prove in general, let alone in individual patients presenting with clinical symptoms. Clinicians should be aware of these facts in decisions regarding treatment recommendations.
MRONJ のリスクあり、またはすでに MRONJ の患者は、MRONJ と混同されない他の一般的な臨床症状を示すことがあることを理解することが重要です。よく誤診される疾患 として歯槽骨炎、副鼻腔炎、歯肉炎/歯周炎、カリエス、根尖病変、歯痛、非定型神経痛、線維性骨膜症、肉腫、慢性硬化性骨髄炎、顎関節症などがありますが、これに限ったものではありません。重要なのは、治癒遅延、骨露出、腐骨化は骨吸収抑制療法を行っていない患者にも起こり得るという事です。
あらゆる薬剤関連の合併症の因果関係の探求は疫学的な視点から行われています。MRONJは稀な疾患で、多因子性であり、骨吸収抑制薬に曝露されていないが同じ臨床像を呈する患者が存在することはよく知られています。骨吸収抑制薬を使用していない患者における顎骨壊死は細菌、ウイルス、真菌の感染、外傷、喫煙、ステロイド、免疫不全、自己免疫疾患、DM、化学療法などによって起こると報告されています。さらに、骨形成不全のような患者集団では、骨吸収抑制薬による治療が行われていますが、MRONJの報告はありません。MRONJに関連する薬剤を投与されている患者の多くは他の疾患を有しており、それが増悪因子や寄与因子かもしれません。これらの交絡要素が発生率や有病率を推定するのを難しくしています。
臨床試験は、有効性と安全性のデータのゴールドスタンダードである一方、まれな事象を実証するための検出力があることはほとんどありません。MRONJが発見される以前に、BP製剤の大規模ランダム化縦断試験で最長10年間の患者データがありましたが、合併症としての顎骨壊死は発見されませんでした。最近のHORIZON Pivotal Fracture trialでは、3,889人の無作為化患者に、年1回のゾレドロン酸投与とプラセボ投与を3年間行い、介入群に1人、プラセボ群に1人の患者がMRONJを発症しました。この試験を6年まで延長したところ、治療群に1名のMRONJ患者が追加されましたた。9年まで延長した結果、MRONJの新たな確認例はありませんでした。
臨床症状を呈している個々の患者はともかく、全体としてみれば、決定的な因果関係を証明することは依然として困難です。臨床医は、これらの事実を認識した上で、治療法の推奨を決める必要があります
PATHOPHYSIOLOGY(病態生理学)
Since the AAOMS position paper in 2014, significant knowledge has been gained regarding MRONJ pathophysiology from both clinical and particularly preclinical animal studies. It should be noted that animal studies have a number of limitations, are most often using supratherapeutic doses and likely do not truly mirror the clinical environment. That said, they are critical in understanding disease mechanisms and can serve as one reference point to evidence-based clinical decision-making.
Much debate persists among clinicians and researchers, contributing to the various treatment protocols utilized for patients today. Disease specificity unique to the jaws has focused leading hypotheses to include bone remodeling inhibition, inflammation or infection, angiogenesis inhibition, innate or acquired immune dysfunction, as well as genetic predisposition. Both animal and human studies suggest that an antiresorptive medication, coupled with inflammation or infection, is necessary and sufficient to induce MRONJ. However, as more knowledge is gained on the subject, it is becoming increasingly apparent that MRONJ is multifactorial, and it is likely that multiple hypotheses can explain the overall pathophysiology of this disease.
2014年のポジションペーパー以来、臨床、動物実験の両面でMRONJの病態生理学に関する多くの知識が得られました。動物実験にはオーバードーズされたり、実際の臨床環境を反映していない事が多いといったLimitationがある事は記載されなければいけません。とはいえ、疾患のメカニズムを理解する上で重要であり、エビデンスに基づく臨床的な意思決定のための一つの参考となるものです。
臨床家や研究者達の間で多くの議論があり、今日の治療プロトコールに寄与しています。顎に特有の疾患特異性から、骨リモデリング阻害、炎症や感染、血管新生阻害、自然・獲得免疫機能障害、遺伝的素因などの仮説が有力視されています。動物とヒトの研究の両方とも、骨吸収抑制療法に炎症か感染が加わる事がMRONJを惹起するのに必要十分条件であると示唆しています。しかし、知識が得られるにつれてMRONJは多因子性の疾患であることが明確になってきており、複数の仮説によって本疾患全体の病態生理を説明できる可能性が高くなっています。
Bone Remodeling Inhibition(骨のリモデリング阻害)
The definition of MRONJ includes oral or parenteral administration of antiresorptive medications, such that bone remodeling suppression is a central hypothesis in its pathophysiology. Antiresorptive medications, including BPs and denosumab (DMB), have direct effects on osteoclast formation, differentiation, or function. In osteoporosis, BPs are a first-line therapy to decrease bone remodeling, increase bone mineral density, and decrease vertebral and long bone fractures. BPs, in higher doses, also are utilized in primary bone malignancy and bone metastases to decrease SREs, including hypercalcemia of malignancy, reduce severe bone pain, and improve quality of life. Although DMB has only been approved for use since 2010, its use has increased significantly for both osteoporosis and malignancy in the last decade. Prevalence of MRONJ with DMB users is at least as high as BP users, likely due to its increased potency to inhibit bone resorption. This is supported in the jaws as animal studies demonstrate absent osteoclasts around the alveolar bone of DMBtreated mice. Human bone specimens also show an increased number of nonfunctional osteoclasts surrounding necrotic bone in BP-treated patients, further reinforcing bone remodeling inhibition as a leading hypothesis in MRONJ pathophysiology. With the appearance of MRONJ in DMB-treated patients, it becomes increasingly apparent that the underlying pathophysiology involves dysfunctional osteoclasts.
Animal studies evaluatingwithdrawal of BPs or DMB further highlight the importance of bone remodeling in MRONJ prevention and resolution. Rodents with established ONJ failed to resolve when antiresorptive were withdrawn. However, discontinuing DMB, but not BPs, prior to tooth extraction successfully prevented MRONJ development in rats. Moreover, parathyroid hormone, which acts directly on osteoblasts to induce bone formation and indirectly increases osteoclastic bone resorption and overall remodeling, has been shown to prevent MRONJ and improve extraction socket healing in rodents and preliminarily in patients. This observation provides further support for the central role of osteoclast inhibition in MRONJ pathogenesis.
MRONJの定義は、経口または非経口での骨吸収抑制薬の投与が含まれ、骨のリモデリングの抑制は病態生理学の主たる仮説の1つです。BP製剤とデノスマブを含む骨吸収抑制薬は破骨細胞の形成、分化、機能に直接的に作用します。BP製剤は、骨のリモデリングを抑制し、骨のミネラル濃度を増加させ、脊椎や長骨の骨折を減少させるための第1選択です。より高用量でのBP製剤は、原発性の骨の悪性腫瘍または骨メタの、高カルシウム血症を含む骨関連イベントの減少、疼痛の減少、QOLの改善のために使用されます。
デノスマブは2010年に使用が承認されたばかりですが、この10年間で骨粗鬆症と悪性腫瘍の両方で使用量が大幅に増加しました。デノスマブ使用者のMRONJの有病率は、少なくともBP使用者と同程度であり、おそらく骨吸収を抑制する作用が強いためと思われます。これは、動物実験でデノスマブ投与マウスの歯槽骨周囲に破骨細胞がなかったことからも支持されます。ヒトにおいてもBP治療患者の壊死骨周囲に、非機能性の破骨細胞の数の増加が認められ、これは骨のリモデリング抑制がMRONJの病態生理学において主たる仮説であることを補強するものです。デノスマブ投与患者におけるMRONJの出現により、その病態の根底には破骨細胞の機能異常があることがますます明らかになってきました。
BP製剤またはデノスマブの投与中止を評価する動物実験により、MRONJの予防と解消における骨リモデリングの重要性がさらに強調されました。顎骨壊死が形成されたネズミは、骨吸収抑制薬を中止しても治癒しませんでした。しかし、抜歯前にBP製剤ではなくデノスマブを中止することで、ラットのMRONJの発生を防ぐことに成功しました。さらに、副甲状腺ホルモンは骨芽細胞に直接作用して骨形成を誘導し、間接的に破骨細胞の骨吸収と全体のリモデリングを増加させます。副甲状腺ホルモンはネズミではMRONJを予防し、抜歯窩治癒を改善しますが、予備的に患者でも示されています。MRONJの発症に破骨細胞の抑制が中心的な役割を果たしていることをさらに裏付けるものです。
Inflammation or Infection(炎症と感染)
Although most studies report tooth extraction as the major inciting event for MRONJ development, it is clear that most extracted teeth had pre-existing periodontal or periapical disease. From this patient information, animal models of inflammation or infection were developed to replicate clinical, radiographic, and histologic features of MRONJ. Presence of inflammatory cytokines, specifically at the site of MRONJ, also support the strong role of inflammation. As evidence of increased systemic inflammation and its contribution to MRONJ development, mice with experimentally induced rheumatoid arthritis demonstrated more severe MRONJ with increased oral bone exposure, more pronounced radiographic features, intense local inflammatory infiltrate, and larger areas of histologic necrosis. Further support for the inflammatory etiology showed that removal of the inflammatory nidus in ligatureinduced periodontitis ameliorated MRONJ development in mice, demonstrating reduced inflammation and prevention of disease progression. Moreover, transplantation of peripheral blood mononuclear cells with anti-inflammatory properties reduced MRONJ prevalence by improving soft-tissue healing, decreasing inflammatory polymorphonuclear cells and inflammatory marker expression, as well as enhancing vascularity. These preclinical findings confirm the irrefutable role of inflammation or infection in MRONJ disease prevalence, severity and resolution.
The presence of bacteria on the exposed necrotic bone also contributes to disease severity, where pain and signs of infection define Stage 2 MRONJ. This is not surprising since poor oral hygiene and biofilm presence are associated with MRONJ development, and oral health maintenance and dental prophylaxis before initiating antiresorptive therapy can decrease MRONJ prevalence. Importantly, clinical treatment protocols to reduce the biofilm and eradicate infection have emerged as important alternatives to debridement and resection in patients who may not be ideal surgical candidates.
MRONJ発症の最もメジャーなイベントは抜歯であると多くの研究が報告していますが、殆どの抜歯された歯はすでに歯周病や根尖性歯周炎などに罹患していた事は確実です。炎症や感染を有する動物実験モデルではMRONJの臨床的、放射線的、病歴特徴が再現されました。炎症性サイトカインがMRONJの部位に特異的に存在することも、炎症が強く関与していることを裏付けています。全身的な炎症の増加とそれがMRONJの発症にもたらす寄与の証拠として、実験的にリウマチに罹患させたマウスでは骨露出の増加、顕著な放射線画像、炎症浸潤、広範囲な壊死などの、よりシビアなMRONJが観察されました。さらに、マウスの歯根膜で誘発された歯周炎の炎症性病巣を除去すると、MRONJの発生が改善され、炎症が抑制され病気の進行が予防されることが示され、炎症性の病因が支持されました。また、抗炎症作用を有する末梢血単核細胞を移植すると、軟組織の治癒の改善、炎症性多核白血球、炎症マーカーの減少、さらに血管分布の増加などにより、MRONJの有病率が減少しました。これらの前臨床試験結果は、MRONJの疾患の有病率、重症度、および治癒において、炎症や感染が否定できない役割を担っていることを裏付けるものです。
露出壊死骨表面の細菌の存在もMRONJの深刻度に影響し、痛みや感染徴候があればステージ2と定義されます。口腔衛生状態が悪くバイオフィルムが存在していることがMRONJの発症に関連していることは驚くことではありません。そして、骨吸収抑制療法前の口腔衛生管理と予防処置はMRONJの有病率を低下させます。重要なことは、バイオフィルムを減少させ、感染を根絶するための治療プロトコールが、理想的な外科手術の候補者ではない患者において、デブリードマンや切除術に代わる重要な選択肢として浮上してきたことです。
Angiogenesis Inhibition(血管新生抑制)
Osteonecrosis is traditionally defined as avascular necrosis or aseptic necrosis, most commonly characterized as osteocyte death after decreased blood flow to the femoral head. However, MRONJ is defined as necrotic bone in the maxillofacial region after exposure to either antiresorptive or antiangiogenic medications. BPs such as zoledronic acid directly inhibit angiogenesis in vitro and in vivo and animal models demonstrate decreased vascularity in sites of MRONJ and decreased microvessel numbers during early stages of bone healing. In addition, angiogenesis normally seen during extraction socket healing is inhibited by BPs, and both BPs and DMB have been shown to decrease arterial area, venous area, and overall vascularity of periodontal tissues during early and late MRONJ development. Importantly, antiangiogenic medications, such as VEGF inhibitors, tyrosine kinase receptor inhibitors, and immunomodulatory drugs, can be associated with MRONJ. Moreover, patients with multiple myeloma receiving both antiresorptive and antiangiogenic medications, as shown in several studies, have a higher MRONJ prevalence. Important aspects of MRONJ treatment include determining disease margins, which can be challenging as microvascular mucosal abnormalities can be seen adjacent to frank MRONJ lesions. It is important to note that the incidence of MRONJ in patients on antiangiogenics is much lower than those taking antiresorptive medications.
骨壊死は伝統的に無血管性または無菌性壊死として定義されています。最も一般的には、大腿骨頭への血流減少後の骨細胞死として特徴付けられます。しかし、MRONJは骨吸収抑制または血管新生抑制薬投与後の顎顔面領域の壊死骨として定義されます。ゾレドロン酸のようなBP製剤はin vitroでもin vivoでも直接的に血管新生を抑制します。また動物実験モデルではMRONJ側の血管分布の減少、治癒早期での微小血管数の減少などが認められました。加えて、抜歯窩治癒で一般的に認められる血管新生はBP製剤によって抑制されます。また、BP製剤とデノスマブはともにMRONJ発症の初期および後期に歯周組織の動脈面積、静脈面積および全体の血管新生を減少させることが示されています。VEGF(血管内皮増殖因子)抑制薬、チロシンキナーゼレセプター抑制薬、免疫調整薬などの血管新生抑制薬はMRONJに関連している可能性があります。さらに、骨吸収抑制薬と血管新生抑制薬両方を服用している多発性骨髄腫の患者はいくつかの論文では高いMRONJの罹患率が報告されています。MRONJの治療で重要なことは、病変の境界を決めることですが、これはMRONJの病変に隣接して微小血管の粘膜異常が見られることがあるため、困難なことが多いです。血管新生抑制薬を使用している患者におけるMRONJの発生率は、骨吸収抑制薬を使用している患者よりもはるかに低いことに留意することが重要です。
Innate or Acquired Immune Dysfunction(免疫不全)
Although animal studies confirm that an antiresorptive medication—coupled with inflammation or infection— is necessary and sufficient to produce MRONJ, not all patients with dental infections develop the disease. It is well-known that patients with medical comorbidities such as diabetes or rheumatoid arthritis or immunocompromised states are at significantly higher risk for MRONJ with or without exposure to antiresorptive agents. Patients with metastatic or primary bone malignancies have a compromised immune system. This also has been confirmed with animal studies, where chemotherapy, steroids, and disease-modifying antirheumatic drugs (DMARDs), combined with antiangiogenic medications and an antiresorptive, increase MRONJ severity or prevalence. Moreover, higher rates of MRONJ occur in patients with multiple myeloma who receive multiple chemotherapeutic agents.
Replenishing the area of nonhealing MRONJ lesions with mesenchymal stem cells (MSCs) to overcome immune dysfunction is a potential area of therapeutic interest, especially in patients who are immunocompromised. A recent study showed altered numbers and patterns of T-cells in human and rat MRONJ necrotic bone samples as compared to healthy patients and non-MRONJ sites. Preclinical studies also demonstrate healing or prevention of MRONJ lesions after systemic infusion with adipose or bone marrow-derived MSCs.
動物実験では、骨吸収抑制薬と炎症または感染の組み合わせがMRONJ発症の必要十分条件と確認されていますが、感染を有する全ての患者にMRONJが起こるわけではありません。DMやリウマチ、免疫不全などの合併症を有する患者は骨吸収抑制薬を投与されていてもいなくてもMRONJのリスクが著明に高い事がよく知られています。骨メタや原発の骨腫瘍などをもつ患者は免疫システムに異常があります。これも動物実験で確認されていますが、化学療法、ステロイド、疾患修飾性抗リウマチ薬(DMARDs)と血管新生抑制薬と骨吸収抑制薬が併用されるとMRONJの有病率や重症度が悪化します。また、多発性骨髄腫で複数の化学療法薬を投薬されている場合もMRONJの発症率が高くなります。
治癒しないMRONJ病変部に間葉系幹細胞(MSC)を補充して免疫機能障害を克服することは、特に免疫不全の患者さんにおいて、治療上の関心事となる可能性があります。最近の研究では、ヒトとラットのMRONJ壊死骨サンプル中のT細胞の数やパターンが健康な患者と異なる事が示されました。前臨床試験でも、脂肪や骨髄由来のMSCを全身に投与すると、MRONJ病変が治癒または予防されることが確認されています。
Genetic Factors(遺伝)
In the 2014 paper, the authors identified several reports describing single-nucleotide polymorphisms (SNPs) that were associated with the development of MRONJ. Most of these SNPs were located within regions of the gene associated with either bone turnover, collagen formation, or certain metabolic bone diseases. Indeed, increasing evidence is available to support the role of SNPs with MRONJ. Specific links to sirtuin-1 (SIRT1), a bone remodeling regulator that promotes bone formation, may be protective against MRONJ if upregulated. SIRT1 also is involved in both reduction of inflammation and induction of angiogenesis, suggesting a role in several of the leading MRONJ hypotheses. Other genes also have been reported to increase MRONJ risk through their role in angiogenesis, bone remodeling, and immune responses, including PPAR gamma, CYP2C8, and many others. Collectively, these studies suggest that MRONJ is a multifactorial disease and that genetic factors may play a role in its development. Overall, however, current studies document either a weak or no association between genetic factors measured and risk for MRONJ. To determine predisposition, studies with larger sample sizes should be performed, with genetic risks confirmed in both BPs and DMBtreated patients who have breast or prostate cancer metastases, multiple myeloma, or osteoporosis.
2014年のポジションペーパーでは、一塩基多型(SNPs)がMRONJの発症と関連しているいくつかの報告を確認していました。一塩基多型の殆どは骨のターンオーバー、コラーゲン生成、骨代謝疾患に関連する遺伝子領域内に存在しています。MRONJへの一塩基多型の役割を支持するエビデンスが増えています。骨形成を促進する骨リモデリング制御因子であるサーチュイン-1(SIRT1)との特異的な関連は、アップレギュレートされればMRONJに対して保護的である可能性があります。SIRT1はまた、炎症の抑制と血管新生の誘導の両方に関与しており、MRONJの主要な仮説のいくつかにおける役割が示唆されています。血管新生、骨のリモデリング、免疫応答の役目を通してMRONJリスクを高めると遺伝子として、PPARガンマ、CYP2C8、や他の多くのものが報告されています。しかし、現在の研究ではMRONJのリスクと遺伝要因との間には関連がない、または弱い関連が報告されているだけです。素因を決定するためには、乳がんや前立腺がんの転移、多発性骨髄腫、骨粗鬆症を有するBP製剤とデスノマブ投与を投与されている患者の遺伝的リスクを確認し、より大きなサンプル数の研究を行う必要があります。
Risk Factors for MRONJ
MEDICATION-RELATED RISK FACTORS
To estimate the risk for medications associated with MRONJ, the primary parameter to be considered is the therapeutic indication for treatment (eg, malignancy or osteoporosis/osteopenia). The data suggest that antiresorptive medications (ie, BPs and DMB) are associated with an increased risk for developing MRONJ. The risk of MRONJ is considerably higher in the malignancy group (<5%) than in the osteoporosis group (<0.05%). Current data are insufficient to identify other medications as risk factors for developing MRONJ.
MRONJに関連する薬剤のリスクを推定するために考慮される主パラメーターは適応症(たとえば悪性腫瘍または骨粗鬆症/骨減少症)です。骨吸収抑制薬(BP製剤とデスノマブ)はMRONJの発症のリスク増加と関連していることがデータから示唆されています。MRONJのリスクは悪性腫瘍群では5%未満のオーダーで、骨粗鬆症群の0.05%未満と比較するとかなり高いです。他の薬剤のリスクを評価するためのデータが現段階では不足しています。
MRONJ risk among cancer patients(がん患者のMRONJリスク)
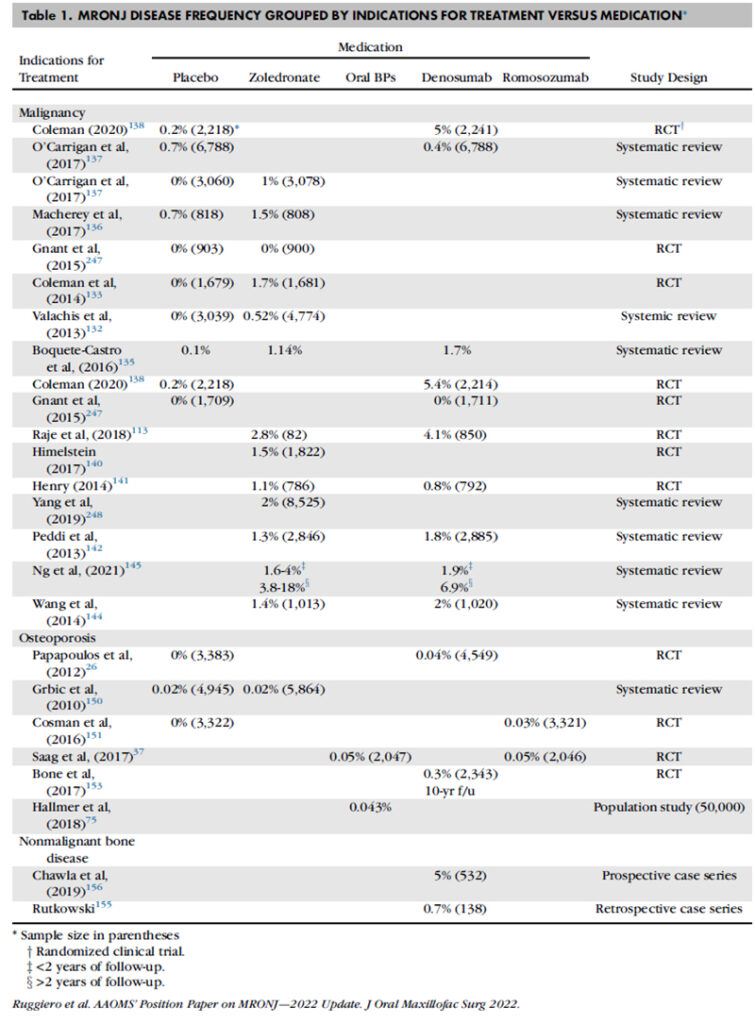
For estimating the risk for MRONJ among patients exposed to a medication, the risk for MRONJ in patients not exposed to antiresorptive medications must be estimated (Table 1). The risk for MRONJ among cancer patients enrolled in clinical trials and assigned to placebo groups ranges from 0 percent to 0.7 percent.
a. Among cancer patients exposed to zoledronate, the cumulative risk of MRONJ clusters in the low single digits, <5 percent, and ranges from 0 percent to 18 percent. The wide variation in estimates may be explained by the varying durations of follow-up, one to 10 years, reported in the various studies. The risk of MRONJ among cancer patients exposed to zoledronate ranges between 2-10 times higher than cancer patients treated with placebo.
b. Among cancer patients exposed to DMB, the risk of MRONJ ranges from 0 percent to 6.9 percent, with most studies reporting rates <5 percent. The risk for MRONJ among cancer patients exposed to DMB is comparable to the risk of MRONJ in cancer patients exposed to zoledronate.
薬剤投与によるMRONJのリスクを推定するためには、骨吸収抑制薬が投与されていない人のMRONJリスクを推定しなければいけません(表1)。臨床試験に登録され、プラセボ群に割り付けられたがん患者のMRONJのリスクは、0%から0.7%となっています。
a ゾレドロン酸を投与されているがん患者では、MRONJの累積リスクは5%未満で、0~18%の範囲でした。大きな範囲となったのはフォローアップ期間によるものかもしれません。1~10年と研究によって開きがありました。ゾレドロン酸投与のがん患者のMRONJリスクは、プラセボ投与のがん患者と比較すると2~10倍でした。
b デスノマブを投与されているがん患者では、MRONJリスクは0~6.9%であり、多くの研究では5%未満でした。ゾレドロン酸投与のがん患者群とほぼ同等のMRONJリスクを示しました。
Since the 2014 update, investigators have implicated numerous families of medications as risk factors for MRONJ. These medications include tyrosine kinase inhibitors (TKIs) such as sunitinib, monoclonal antibodies (bevacizumab), fusion proteins (aflibercept), mTOR inhibitors (everolimus), radiopharmaceuticals (radium 223), selective estrogen receptor modulators (raloxifene), and immunosuppressants (methotrexate and corticosteroids). When compared to antiresorptive medications, the level of evidence supporting other medication families as risk factors for MRONJ is level 5 (eg, isolated case reports or mini-case series [<5 cases]). Given that the poly-pharmaceutical management of cancer patients combined with the fact that cancer and immunosuppression are risk factors for MRONJ without exposure to antiresorptive agents, AAOMS believes that identifying a single medication as being the etiologic agent for MRONJ seems unlikely in case reports or mini-case series. Further controlled prospective studies will be required to measure the risk of MRONJ associated with non-antiresorptive agents.
2014年のアップデート以来、研究者はMRONJの危険因子として多数の薬物ファミリーを示唆しています。スニチニブのようなチロシンキナーゼ抑制薬、モノクローナル抗体(ベバシズマブ)、融合蛋白質(アフリベルセプト)、mTOR抑制薬(エベロリムス)、放射線医薬品(ラジウム223)、選択的エストロゲン受容体修飾薬(ラロキシフェン)、免疫抑制薬(メトトレキサートとコルチコステロイド)などが含まれます。骨吸収抑制薬と比較した場合、MRONJのリスクファクターとしての他の薬物ファミリーを支持するエビデンスレベルはレベル5(孤立したケースレポートまたは5症例未満のミニケースシリーズ)です。がん患者の多剤併用療法と、骨吸収抑制薬を投与されていない場合でもがんと免疫抑制はMRONJリスクとなる事実を考慮すると、AAOMSは、症例報告やミニケースシリーズにおいて単一の薬剤がMRONJの病因であると特定することは考えにくい、と考えています。さらなるコントロールされた縦断研究が必要です。
MRONJ Risk Among Osteoporosis Patients
Most dentists and oral and maxillofacial surgeons evaluate patients in their practices exposed to antiresorptive therapy for management of osteoporosis (Table 1).
a. Risk for MRONJ among osteoporotic patients exposed to BPs.
The risk of MRONJ among study subjects assigned to placebo groups enrolled in osteoporosis clinical trials ranged from 0 percent to 0.02 percent.26,150,151 Among study subjects treated with BPs, the risk of MRONJ is 0.02 percent to 0.05 percent. Among patients exposed to IV zoledronate, the risk for MRONJ is estimated to be #0.02% (# 2 per 10,000). For patients exposed to oral bisphosphonates, MRONJ risk is estimated to be #0.05% (# 5 per 10,000).
b. MRONJ risk among osteoporotic patients exposed to RANK-L inhibitors.
After 10 years of follow-up, among patients exposed to DMB, the risk for MRONJ was reported to be 0.3 percent, almost an order of magnitude higher than for BPs.
c. The risk for MRONJ when exposed to romosozumab (0.03 percent to 0.05 percent) is comparable to alendronate (0.05 percent).37,151 In the placebo group, there were no cases of MRONJ.151 It will be important to continue to monitor romosozumab to assess its role as a risk factor for MRONJ.
The risk for MRONJ among osteoporosis patients treated with BPs ranges from 0.02 percent to 0.05 percent and overlaps the risk for MRONJ of patients enrolled in placebo groups (0 percent to 0.02 percent). The risk for MRONJ among patients treated with denosumab, however, has a larger range—from 0.04 percent to 0.3 percent. As such, additional research will be needed to better estimate the risk of MRONJ among patients receiving denosumab. The risk of MRONJ for patients exposed to romosozumab (0.03 percent to 0.05 percent) more closely aligns with the risk associated with BPs. However, given its recent introduction as a therapeutic agent, additional research will be needed to refine its association and risk estimate for MRONJ. Based on this current review of data, the risk of developing MRONJ among osteoporotic patients exposed to BPs, DMB, and romosozumab is low. The occurrence of cases seen is best explained by a rare event among a large number of patients, 5.1 million over the age of 55, exposed to these drugs.
ほとんどの歯科医師と口腔外科医は、骨粗鬆症の管理のために骨吸収抑制療法を受ける診療所の患者を評価しています(表1)。
a BP製剤投与中の骨粗鬆症患者のMRONJリスク
骨粗鬆症でプラセボを投与された患者のMRONJリスクは0~0.02%と報告されています。BP製剤投薬群では0.02~0.05%でした。ゾレドロン酸投与群のMRONJリスクは0.02%以下(10000人中2名以下)と推定されました。経口BP製剤投与群のMRONJリスクは0.05%以下(10000人中5名以下)と推定されました。
b RANK-L抑制薬投与中の骨粗鬆症患者のMRONJリスク
10年のフォローアップ期間後のデスノマブ投与患者のMRONJリスクは0.3%と報告されており、BP製剤投与患者よりも1桁高い数字が報告されています。
c ロモソズマブ投与によるMRONJリスクは0.03~0.05%であり、アレンドロン酸の0.05%とほぼ同等でした。プラセボ群ではMRONJケースはありませんでした。ロモソズマブのMRONJリスクを評価するには調査を続けていく事が重要です。
BP製剤を投与されている骨粗鬆症患者のMRONJリスクは0.02~0.05%であり、0~0.02%のプラセボ群とオーバーラップしています。デノスマブを投与されている骨粗鬆症患者のMRONJリスクは0.04~0.3%と幅がありました。デノスマブのリスクの推定に関してはさらなる研究が必要です。ロモソズマブのMRONJリスクは0.03~0.05%で、BP製剤とあまり変わらない結果でした。しかし、ロモソズマブは新しい薬であり、リスクの推定にはさらなる研究が必要です。
最近のreviewに基づくと、骨粗鬆症患者のMRONJ発症リスクはBP製剤、デノスマブ、ロモソズマブ共に低い値となっています。55歳以上の510万人の投薬患者の中でのレアイベントという説明が最も適切かと思われます。
MRONJ Risk Among Patients with Nonmalignant Bone Disease(骨の非悪性腫瘍患者)
a. AAOMS identified two studies where DMB was used to manage aggressive giant cell tumors of bone. The risk of developing MRONJ in the two studies was broad and ranged from 0.7 percent to 5 percent. This is comparable to the risks of developing MRONJ in subjects treated with DMB for malignancies (range = 0 percent to 6.9 percent). Additional studies will be needed to confirm the risk estimate for MRONJ among patients with nonmalignant bone disease treated with antiresorptives.
b. There are very limited data describing the occurrence of MRONJ in the pediatric population for osteogenesis imperfecta and other conditions. In a systematic review estimating the risk of MRONJ among children with osteogenesis imperfecta, there were no cases of MRONJ identified in a sample of 486 subjects treated for 4.5 to 6.8 years. In a different systematic review that estimated the risk for MRONJ among those under the age of 24 for several conditions treated using BPs, no cases of MRONJ were reported. The overall quality of the studies included in both systematic reviews was limited by small sample sizes or lack of MRONJ-related risk factors.
a AAOMSは侵襲性骨巨細胞腫にデスノマブが使用された報告を2つ確認しています。この2つの報告の結果ではMRONJのリスクは0.7~5%と大きな開きが認められました。これは悪性腫瘍にデスノマブを使用した際の0~6.9%とほぼ同様でした。MRONJのリスクを推定するためにはさらなる研究が必要です。
b 骨形成不全症やその他の症状で小児に起こるMRONJについては極めて限定的なデータしか存在しません。小児の骨形成不全症のMRONJリスクを検討したあるシステマティックレビューによると、4.5~6.8年治療した486名の被験者でMRONJを発症したケースはありませんでした。24歳以下の何らかの既往でBP製剤を使用している場合のMRONJリスクを検討した別のシステマティックレビューでも、発症ケースはありませんでした。このシステマティックレビューに含まれる研究の質は、両方ともサンプルサイズが小さかったりMRONJ関連の危険因子がないために低いと考えられます。
Duration of Medication Therapy as a Risk Factor for MRONJ(投薬期間)
Regardless of indications for therapy, the duration of antiresorptive therapy is a risk factor for developing MRONJ. Among cancer patients exposed to zoledronate or DMB (n = 5,723), the risk of developing MRONJ was, respectively, 0.5 percent and 0.8 percent at 1 year, 1.0 percent and 1.8 percent at 2 years, and 1.3 percent and 1.8 percent at 3 years. In a study by Saad et al, the investigators combined threeblinded phase three trials and found similar results, including a plateau after 2 years for patients exposed to DMB. In a more recent systematic review by Ng et al, the risk of MRONJ among cancer patients treated with zoledronate, was 1.6 percent to 4 percent after 2 years of treatment and 3.8 percent to 18 percent with more than 2 years of treatment. Likewise, for DMB, the risks for developing MRONJ were 1.9 percent and 6.9 percent with <24 months and >24 months of exposure, respectively.
For patients receiving bisphosphonate therapy to manage osteoporosis, data regarding duration are mixed. Early on, the prevalence of MRONJ was reported as increasing over time from near 0 percent at baseline to 0.21 percent after four or more years of BP exposure based on retrospective analysis. More recent data from a large prospective, randomized placebo controlled trial demonstrate no significant increase in MRONJ in patients treated for up to 9 years. In addition, there are no postmarketing data or general clinical experience to support an MRONJ prevalence of 0.21 percent in any osteoporosis-treated group. Therefore, while duration may be a risk factor, the overall risk remains low.
治療方法にかかわらず、骨吸収抑制療法の期間はMRONJのリスクです。がん患者へのゾレドロン酸またはデノスマブを投薬した5723ケースでは、MRONJ発症リスクは1年で0.5~0.8%、2年で1.0~1.8%、3年で1.3~1.8%となりました。Saadらによる研究では、3つのブラインドされた第3相試験を組み合わせて、DMBを投与された患者のリスクが2年後にプラトーになるなど、同じ様な結果が得られています。Ngらによる新しいシステマティックレビューでは、ゾレドロン酸を投与されているがん患者のMRONJリスクは2年間の投与で1.6~4.0%、2年以上の投与で3.8~18%と報告しています。同様にデノスマブでは24か月未満の投与で1.9%、24か月より期間が長くなると6.9%と報告しています。
骨粗鬆症のためにBP製剤を投与している患者の場合、投与期間によるリスクはまちまちな結果となっています。後ろ向きでの研究で得られたデータから、最初は0%付近だったMRONJの有病率は4年、またはそれ以上の投与で0.21%まで経時的に増加すると過去には報告されました。最近の大規模な縦断、ランダマイズ、コントロール研究ではMRONJの発症リスクは最長9年まで有意な増加は認められませんでした(文献18,60,61)。加えて、骨粗鬆症患者における MRONJ 有病率 0.21%を支持する市販後データおよび一般的な臨床経験はありません。そのため、投薬期間はリスクではありますが、リスク自体はかなり低いと言えます。
LOCAL FACTORS
Dentoalveolar Operations(外科処置)
Dentoalveolar operations are the most common identifiable predisposing factor for developing MRONJ. Several studies report that among patients with MRONJ, tooth extraction is cited as a predisposing event ranging from 62 percent to 82 percent. While this information is important, it is not what most patients or clinicians want to know. Most providers and patients want an answer to the following clinical question: ‘‘Among patients exposed to antiresorptive medications, what is the risk for developing MRONJ following tooth extraction (or other dentoalveolar procedures such as implant placement or periodontal procedures)?’’ Current estimates for the risk of MRONJ among osteoporotic patients exposed to BPs following tooth extraction range from 0 percent to 0.15 percent. For osteoporotic patients exposed to DMB, the risk for MRONJ following tooth extraction was 1 percent.
For cancer patients exposed to BPs, the risk of developing MRONJ after tooth extraction ranges from 1.6 percent to 14.8 percent. In a small case series, n = 61 subjects having 102 extractions, the risk for MRONJ after tooth extraction was 13.1 percent. In a systematic review by Gaudin et al, the risk for MRONJ after tooth extraction (n = 564) was estimated to be 3.2 percent. While the estimates for developing MRONJ in high-risk patients undergoing tooth extraction vary, they cluster between 1 percent and 5 percent, similar to estimates of osteoradionecrosis following tooth extraction in irradiated patients.
The risk of developing MRONJ among patients who have been exposed to antiresorptive medications for other dentoalveolar operations such as dental implant placement and endodontic or periodontal procedures is unknown. The risk for MRONJ after implant placement among patients treated with DMB has been reported to be 0.5 percent. Absent better data, AAOMS cautions the use of these procedures in cancer patients exposed to antiresorptive therapies and recommends osteoporosis patients be informed of potential risks, albeit low, including development of MRONJ, early and late implant failure all of which have been described in case reports and clinical trials.
歯槽骨の手術は、MRONJを発症する最も一般的な要因であることが確認されています。MRONJを有する患者についてのいくつかの報告では、抜歯が契機と報告されたのが62~82%でした。この情報は重要ではありますが、患者や臨床家の殆どが知りたいことではありません。彼らは以下の様な臨床的疑問に対する答えを求めています。「骨吸収抑制薬を投薬されている患者では、抜歯(またはインプラントや歯周外科などの別の外科処置)後に起こるMRONJ発症のリスクは何なのか?」現在、BP製剤投与中の骨粗鬆症の患者で抜歯後にMRONJが起こるリスクは0~0.15%と推定されています。デノスマブの場合は1%と報告されています。
がん患者でBP製剤投薬中では、抜歯後にMRONJが発症するリスクは1.6~14.8%と報告されています。あるスモールケースでは61名の被験者で102本抜歯し、MRONJ発症リスクは13.1%でした。Gaudinらによるシステマティックレビューでは564本の抜歯後にMRONJが発症したのは3.2%でした。ハイリスク患者の抜歯によるMRONJ発症リスクは、ばらつきがあるものの1~5%の間に大体収まり、放射線照射患者の抜歯後に骨放射線壊死する確率とほぼ同じでした。
骨吸収抑制薬を投与されている患者におけるインプラントやエンド、ペリオの外科処置によるMRONJ発症リスクはよく分かっていません。デノスマブ投薬中のインプラント治療によるMRONJ発症リスクは0.5%と報告されています。よいデータがないため、AAOMSは骨吸収抑制薬を投与されているがん患者に対してこのような外科処置へ注意を促し、骨粗鬆症患者に関しては症例報告や臨床試験で報告されているMRONJの発症、早期および後期のインプラント失敗など、低いとはいえ潜在的リスクについて説明するよう推奨しています。
Anatomic Factors
Limited new information regarding anatomic risk factors for MRONJ is available. MRONJ is more likely to appear in the mandible (75 percent) than the maxilla (25 percent) but can appear in both jaws (4.5 percent). Denture use was associated with an increased risk for MRONJ among cancer patients exposed to zoledronate (OR = 4.9; 95 percent CI = 1.2 to 20.1). In a study by Vahtsevanos et al, a sample of 1,621 cancer patients treated with intravenous zoledronate, ibandronate or pamidronate, there was a two-fold increased risk for MRONJ among denture wearers.
MRONJの解剖学的なリスクについての新しい情報は限定的です。MRONJは上顎(25%)よりも下顎(75%)に出現しやすいですが、両顎に4.5%に出現することもあります。ゾレドロン酸を投与されているがん患者での義歯使用はMRONJリスクが増加します(OR = 4.9; 95 percent CI = 1.2 to 20.1)。Vahtsevanosらは、ゾレドロン酸、イバンドロン酸、パミドロン酸を静注されているがん患者1621名では義歯使用によりMRONJのリスクは2倍になると報告しています。
Concomitant Oral Disease(随伴する口腔疾患)
Pre-existing inflammatory dental disease such as periodontal disease or periapical pathology is cited as a risk factor. Among cancer patients with MRONJ, the pre-existing inflammatory dental disease was a risk factor among 50 percent of the cases. Given that a common treatment of inflammatory dental disease is tooth extraction, pre-existing dental disease may confound the relationship between tooth extraction and risk for MRONJ. Tooth extraction may expose MRONJ as opposed to being the precipitating event. It would be valuable to see an estimate of the association between tooth extraction and MRONJ adjusted for pre-existing inflammatory dental disease. After tooth extraction and periodontal disease, the next most common risk factor is reported as ‘‘spontaneous’’ MRONJ with no identifiable dental risk factor.
歯周病や根尖性歯周炎などの炎症性歯科疾患はリスクファクターとして報告されています。MRONJを有するがん患者では、50%で抜歯前の炎症性歯科疾患がリスクファクターとなっていました。炎症性歯科疾患の一般的な治療は抜歯であることを考えると、歯科疾患は抜歯とMRONJリスクの関係を混乱させるかもしれません。抜歯は、MRONJの発症を促すものではなく、MRONJを露出させるものです。炎症性歯科疾患の既往を調整した抜歯とMRONJの関連性の推定を見ることは価値があります。抜歯と歯周病の次に多い危険因子は、歯科的なリスクファクターを特定できない”自然発症”のMRONJと報告されています。
DEMOGRAPHIC AND SYSTEMIC FACTORS AND OTHER MEDICATIONS
Age and sex are variably reported as risk factors for MRONJ.5,165,169-171 The higher prevalence of MRONJ in the female population is likely a reflection of the underlying disease for which the agents are being prescribed (eg, osteoporosis, breast cancer). As noted previously, those under the age of 24 treated with antiresorptives for benign bone diseases have not demonstrated any risk for MRONJ even after an extended duration of therapy. The overall quality of the studies included even in systematic reviews is based on small sample sizes and the lack of other MRONJ-related risk factors. The risk of developing MRONJ in the pediatric population requires continued surveillance.
Corticosteroids are associatedwith an increased risk forMRONJ. There are concerns that corticosteroids increase the risk for MRONJ when given in conjunction with antiresporptive agents.
Comorbid conditions are inconsistently reported to be associated with an increased risk for MRONJ, including anemia (hemoglobin < 10 g/dL) and diabetes. Cancer type also is variably reported as a risk factor.
Tobacco use is variably reported as a risk factor for MRONJ. In a case-control study, tobacco use approached statistical significance as a risk factor for MRONJ in cancer patients (OR = 3.0; 95 percent CI = 0.8 to 10.4).169 In a more recent case-controlled study, tobacco use was not associated with ONJ in a sample of cancer patients exposed to zolendronate. Vahtsevanos did not report an association between tobacco use and MRONJ.
In brief, after chemotherapy and corticosteroid exposure, the next most reported comorbidity is ‘‘no comorbidity.
In summary, the current literature reaffirms that the risk of MRONJ is significantly greater in cancer patients receiving antiresorptive therapy compared to patients receiving antiresorptive therapy for osteoporosis. Moreover, the risk of MRONJ in osteoporosis patients receiving antiresorptive therapy continues to be very low regardless of drug type (BPs, DMB, romoszumab) or dosing schedule.
年齢と性別はMRONJリスクファクターとして報告されています。女性の高い有病率は骨粗鬆症や乳がんなどの女性に多い疾患を反映したものと考えられます。
以前に記載しましたが、良性の骨腫瘍で骨吸収抑制薬を投与されている24歳以下は治療期間が延長してもMRONJのリスクは認められませんでした。ただし、システマティックレビューに含まれるこれらの研究の質はサンプルサイズが小さく、他のMRONJに関連するリスクファクターが考慮されていない研究に基づいています。小児のMRONJ発生リスクについては更なる調査が必要です。
副腎皮質ホルモンはMRONJリスクと関連します。骨吸収抑制薬と併用された場合、副腎皮質ホルモンはMRONJリスクを上昇させます。
貧血(ヘモグロビン<10g/dL)および糖尿病などの併存疾患がMRONJのリスク上昇に関連することは一貫した報告がされていません。 また、癌の種類も危険因子として様々な報告がなされています。
喫煙はMRONJのリスクファクターである事が報告されています。ケースコントロールスタディでは、がん患者において有意にMRONJリスクである事が示唆されています(OR = 3.0; 95 percent CI = 0.8 to 10.4)。ただし、最近のケースコントロールスタディでは、ゾレドロン酸投与中のがん患者でONJの発生と相関しませんでした。Vahtsevanosは、タバコの使用とMRONJとの関連を報告していません。
化学療法と副腎皮質ホルモンの次に多く報告されているのは、「併存疾患なし」です。(注:おそらく、何も無くても起こる可能性があるという事)
まとめると、骨吸収抑制療法をうけているがん患者のMRONJリスクは、骨吸収抑制療法をうけている骨粗鬆症患者よりも有意に高い、ということが最近の論文から再確認できます。さらに、骨粗鬆症で骨吸収抑制療法を受けている人は、薬剤の種類、期間に関係なくMRONJリスクはかなり低いと考えられます。
Management Strategies
TREATMENT GOALS(治療のゴール)
The major goals of treatment for patients at risk of developing or who have established MRONJ are:
・Prevention of MRONJ (see section MRONJ risk among cancer patients below).
・Prioritization and support of continued oncologic treatment in patients receiving antiresorptive therapy alone or in combination with immune modulators or antiangiogenic medications:
Oncology patients benefit from the therapeutic effect of antiresorptive therapy by controlling bone pain and reducing the incidence of other SREs.
・Prioritization and support of continued bone health and the prevention of fragility fractures
Patients with osteoporosis, osteopenia, and other metabolic bone diseases benefit from antiresorptive therapy by significantly reducing the risk of fragility fractures and other skeletalrelated events.
・Preservation of quality of life through:
Patient education and reassurance.
Control of pain.
Control of secondary infection.
Prevention of extension of lesion and development of new areas of necrosis.
MRONJリスクがある、またはすでにMRONJが出来てしまっている患者における治療の主なゴールは以下の通りです。
・MRONJの予防
・骨吸収抑制療法単独、または免疫調整薬、血管新生抑制薬の併用を行っている患者におけるがん治療継続の優先順位付けとサポート
がん患者は骨吸収抑制療法の効果として、骨の痛みをコントロールしてその他の骨に関連するイベントの減少が得られます。
・骨の健康状態、病的骨折防止の継続の優先順位付けとサポート
骨粗鬆症、骨減少症、そのたの代謝性骨疾患を有する患者は骨吸収抑制療法の効果として、病的骨折、その他の骨に関連するイベントの減少が得られます。
・以下の項目によるQOLの維持
患者教育と安心
ペインコントロール
二次感染のコントロール
骨壊死領域の拡大防止、新規部位発生予防
PREVENTION OF MRONJ(予防)
Numerous studies demonstrate potentially modifiable factors for reducing the risk of MRONJ, including performing high-risk surgical procedures prior to initiating therapy, using preoperative and postoperative antibiotics and antimicrobial mouth rinses, primarily closing extractions sites, and maintaining good oral hygiene. Maximizing overall patient health is always indicated, such as smoking cessation and diabetes optimization. Although no individual strategy nor collection of strategies eliminates all MRONJ risks, these preventive procedures are recommended.
The prevention of MRONJ begins with the realization that patients receiving antiresorptive therapies may have altered osseous wound-healing capacity, which may also be a risk for developing MRONJ. Similar to other common preventive strategies in medicine and dentistry, healthcare providers need to recognize the importance of coordinated dental care and pretreatment management in minimizing the risk of MRONJ. This requires a continuous effort to educate patients, dentists, and medical professionals about the real risks associated with these therapies and clinical prevention paradigms that can mitigate MRONJ development.
AAOMS re-emphasizes the importance of a multidisciplinary approach to the treatment of patients who are receiving antiresorptive therapies. This may also apply to other immune modulators or targeted therapies taken alone or in combination with antiresorptives. This approach includes consultation with an appropriate dental professional when it is determined a patient would benefit from these therapies.
MRONJリスクを低下させる可能性のある因子については数多くの研究があります。例えば、初期治療の前にハイリスクの外科処置を行う、術前、術後に抗菌薬投与、抗菌薬の洗口、抜歯後の閉創、口腔衛生状態の維持等などです。患者の健康状態を最大限にする手段はいつも示唆されています。例えば、喫煙を中止したりDMをコントロールするなどです。個々の対策や対策の集合体が、すべてのMRONJのリスクを排除するわけではありませんが、これらの予防策が推奨されます。
骨吸収抑制療法をうけている患者は骨の創傷治癒能力が変化しているかもしれない、それはMRONJのリスクとなりうる、ということを認識する事からMRONJの予防は始まります。医学や歯科医学における他の一般的な予防戦略と同様に、医療従事者は、MRONJのリスクを最小限に抑えるために、連携した歯科治療と治療前管理の重要性を認識する必要があります。そのためには、患者さん、歯科医師、医療関係者に、これらの治療法に伴う真のリスクと、MRONJ発症を軽減する臨床予防のパラダイムについて、継続的に教育する努力が必要です。
骨吸収抑制療法をうけている患者さんには多職種連携のアプローチが重要である事をAAOMSは再び強調します。このことは、他の免疫調整剤や標的治療薬を単独で、あるいは抗骨格剤と組み合わせて使用する場合にも当てはまると思われます。このアプローチでは、患者さんにこれらの治療法が有効であると判断した場合、適切な歯科専門職とのコンサルテーションを行います。
Optimization of Oral Health
The 2014 AAOMS position paper identified valid prophylactic treatment strategies that reduce the incidence of MRONJ. The efficacies of these strategies remain validated by subsequent studies that demonstrate the importance of pretreatment dental screening and regimented dental surveillance. There is a robust level of support for early screening and initiation of appropriate dental care prior to the initiation of antiresorptive therapy
These preventive management strategies not only decrease the risk for MRONJ but accrue the benefits that all patients enjoy with optimum oral health.
In a prospective study of prostate cancer patients with bone metastasis, instituting a more regimented dental health surveillance system resulted in a 2.5fold reduction in relative risk compared to symptomatically driven dental treatment. In a systematic review aimed at identifying prevention strategies associated with tooth extractions in patients at risk for MRONJ, no randomized clinical trials were reported. However, there are many animal studies that demonstrate that periodontal or periapical inflammation plays a key role in creating a local environment that supports the development of bone necrosis in the context of systemic antiresorptive therapy.
2014年のポジションペーパーにおいても、妥当な予防的治療アプローチがMRONJの発生を減少させることは確認していました。これらの有効性は、治療前のスクリーニングと定期的な歯科検診の重要性を示すその後の研究によって検証され続けています。早期のスクリーニングと骨吸収抑制療法開始前に適切なデンタルケアを開始することはかなり強いレベルで支持されます。
これらの予防的な管理はMRONJのリスクを低下させるだけでなく、全ての患者が自分に最適な口腔の健康状態を得る事が出来ます。
骨メタを伴う前立腺がん患者の縦断研究によると、定期的な歯科検診は対処療法的な歯科治療と比較して2.5倍MRONJのリスクを低下させる結果となりました。MRONJリスクのある患者の抜歯に関連した予防戦略の確認を目的としたシステマティックレビューでは、処置をランダマイズした研究は報告されていません。しかし、動物実験では、骨吸収抑制療法下において、歯周炎と根尖性歯周炎が骨壊死に適した環境を形成する重要な役割を果たすことが実証されています。
Treatment planning for patients at risk of developing MRONJ should include a thorough examination of the oral cavity and a radiographic assessment when indicated. It is important to identify both acute infection and sites of potential infection to prevent future sequelae that could be exacerbated once drug therapies begin. Considerations during the clinical and radiographic assessment include patient motivation, patient education regarding dental care, fluoride application, chlorhexidine rinses, tooth mobility, periodontal disease, presence of root fragments, caries, periapical pathology, edentulism, and denture stability.
An additional benefit of early dental consultation, when the use of antiresorptive therapy is being considered, is that the patient is informed of the risk associated with these drug therapies and the risk incurred by not undergoing recommended dental preventive measures before consenting to treatment.
MRONJリスクのある患者の治療計画立案には、口腔内の診査と必要であれば放射線の診査が必要です。将来の後遺症を防ぐために急性感染と感染の可能性がある部位を特定することが重要です。この後遺症は一度薬物療法が始まると悪化する可能性があります。臨床的・放射線的評価において考慮すべきことは、患者のモチベーション、歯科治療に関する患者教育、フッ素塗布、クロルヘキシジン洗浄、歯の動揺、歯周病、歯根片(残根?)の存在、カリエス、根尖性歯周炎、無歯顎、義歯の安定性などです。
Cessation of At-Risk Medication Therapy (Drug Holiday) Prior to Tooth Extraction or Other Procedures that Involve Osseous Injury (eg, Dental Implant Placement, Periodontal or Apical Endodontic Treatment) 抜歯前の投薬中止と他の骨に侵襲を与える治療(インプラント、ペリオ、エンドの外科的治療)
The clinical practice of antiresorptive drug holidays to mitigate MRONJ risk in patients undergoing dentoalveolar surgery was controversial at the time of the previous AAOMS position paper in 2014 and remained the case in 2021. While the practice of a drug holiday has been accepted and recommended by several international professional societies, the evidence to support or refute such positions remains inconclusive. The difficulty in establishing or refuting the efficacy of drug holidays is due to the rarity of MRONJ in these patient populations. Therefore, since few events are reported, randomized-controlled trials provide insufficient data to create sound treatment protocols. In a 2020 systematic review that studied the efficacy of antiresorptive drug holiday in preventing MRONJ, a variety of papers were identified with differing conclusions suggesting that a high level of evidence for supporting or refuting the use of a holiday is missing.
The historical use of a drug holiday was intended to decrease the prevalence of MRONJ subsequent to the performance of high-risk surgical procedures. The concern regarding this practice is the loss of efficacy of antiresorptive therapy with the development of SREs and fragility fractures. Among others, factors for consideration may include disease-related risk (cancer vs osteoporosis), drug-dosing frequency, duration of therapy, comorbidities, other medications (especially chemotherapy, steroids, or antiangiogenics), degree of underlying infection/inflammation, and extent of surgery to be performed.
MRONJリスクを下げるための外科処置の前の骨吸収抑制薬の休薬については2014年のポジションペーパーの時点で賛否両論があり、2021年でもその状況は変わっていません。休薬はいくつかの国際学会で承認推薦されていますが、支持する、反対するエビデンスもありいまだ結論はでていません。MRONJが発生する確率がかなり低いため、休薬効果の妥当性を検証するのが困難となっています。報告される症例が少ないため、ランダム化比較試験は健全な治療プロトコルを作成するための十分なデータを提供していません。2020年の休薬がMRONJ予防に与える効果についてのシステマティックレビューでは異なった結論の様々な報告が確認されましたが、エビデンスレベルの高いものはありませんでした。
休薬はリスクの高い外科処置の後に発生するMRONJの有病率を減少させる傾向がありました。休薬に関する懸念としては、骨関連イベントや病的骨折などの骨吸収抑制療法で期待されている効果がなくなってしまう事です。他の考慮すべき要素として、疾患によるリスク(がん vs 骨粗鬆症)、投薬頻度、投薬期間、合併症、他の薬剤(特に化学療法、ステロイド、血管新生抑制薬)、炎症や感染の程度、外科処置の範囲、などがあります。
Of note, the working group was unable to reach a consensus regarding a recommendation on drug holidays and was evenly split between offering drug holidays to patients on a case-by-case basis using prior recommendations and those who never recommend drug holidays, believing that the risks of potential deleterious effects of suspending antiresorptive therapy may outweigh a benefit.
A special concern should be considered for suspending RANKL inhibitors in osteoporosis patients. Several studies have demonstrated a rebound increase in bone resorption following the discontinuation of DMB, resulting in an increased risk of multilevel vertebral fractures. If DMB is to be suspended, the timing and duration of the holiday should be optimized in order to minimize this risk. The planned dentoalveolar surgery can be completed 3-4 months following the last dose of DMB when the level of osteoclast inhibition is waning. It can then be reinstituted 6-8 weeks postsurgery. This management strategy minimizes the length of the drug holiday while maintaining a favorable environment for bone healing.
本ワーキンググループは休薬を推奨することに関してコンセンサスを得ることは出来ませんでした。過去の勧告を参考にケースバイケースで患者さんに休薬させる意見と、骨吸収抑制療法の中断による潜在的な有害作用のリスクが利益を上回ることから休薬を決して推奨しない意見に真っ二つに分かれました。
骨粗鬆症患者におけるRANKL抑制薬の休薬に関しては特に考えなければいけません。いくつかの研究ではデノスマブの中止により骨吸収がリバウンドし、脊椎多発骨折のリスクが増加する事が報告されています。デノスマブを中止するなら、リスクを最小にするようにタイミングと期間を考慮する必要があります。歯槽部の手術は、破骨細胞抑制効果が弱まるデノスマブ最終投与から3~4か月後に行うことができます。手術後6~8週で再設定する事ができます(再投薬する事が出来るという意味?)。この方法は、骨治癒に好ましい環境を維持しながら、休薬期間を最少化することができます。
Bone Turnover Markers.
Since the 2014 AAOMS position paper, there has been a shift away from bone turnover markers. No biomarkers are validated for clinical decision-making, and continued research and prospective studies are required before these markers can be considered efficacious tools in estimating MRONJ risk.
2014年のポジションペーパー以来、骨代謝マーカーからの移行が進んでいます。臨床的な決断に妥当なバイオマーカーが存在しません。これらのマーカーがMRONJのリスクを推定する有効なツールと考えられるようになるには、更なる継続的な研究と縦断研究が必要です。
Other Biomarkers
Biomarkers related to angiogenesis, VEGF activity, endocrine function, and PTH have more recently been described. These markers remain at an exploratory stage and are not yet validated for clinical decision-making.
血管新生、VEGF活動、内分泌機能、PTHに関するバイオマーカーが最近記述されています。これらのマーカーはまだ検討段階であり、臨床的な決断に使えるものではありません。
PREVENTION STRATEGIES(予防戦略)
Patients scheduled to initiate antiresorptive treatment for cancer therapy(がん治療のため骨吸収抑制療法を開始する予定)
The treatment objective for this group of patients is to minimize the risk of developing MRONJ (Table 2). Although a small percentage of patients receiving antiresorptives develop osteonecrosis of the jaw spontaneously, the majority of affected patients experience this complication following dentoalveolar surgery. Therefore, if systemic conditions permit, initiation of antiresorptive therapy should be delayed until dental health is optimized. This decision must be made in conjunction with the treating physician and dentist and other specialists involved in the care of the patient. There is widespread consensus that optimizing dental health prior to initiating therapy is efficacious and of paramount importance. Medical oncologists should educate their patients about the importance of dental health and the efficacy of prophylactic dental treatment in the prevention of MRONJ. Similar to patients who are to receive radiation therapy, optimizing the dental health in patients receiving antiresorptives or other therapies that can compromise bone healing is essential. The pretreatment evaluation of dental health must extend beyond a review of systems and include a physical and radiographic exam. Therefore, a comprehensive dental examination performed by a dental health professional would be a prudent approach for all patients prior to receiving antiresorptive therapy for malignant disease. This level of dental health assessment is most appropriately performed by a dental health professional.
この患者さん達の治療目標はMRONJ発生リスクを最小化する事です(表2)。骨吸収抑制薬を投与されている患者のごく僅かが自然に骨壊死に至りますが、大半は外科処置後に経験します。そのため、全身状態が許せば、口腔内の健康状態が改善されるまで骨吸収抑制療法の開始を遅らせるべきです。この決定は、患者の治療に関わる医師、歯科医師、他のスペシャリストの総意である必要があります。治療開始前に口腔内の健康を最適化することが有効であり、最も重要であることは広く認識されています。放射線治療をうける患者と同様に、骨吸収抑制薬や骨の治癒を抑制するような薬剤を投与されている患者の口腔内の健康状態を最適化することは重要です。治療前の口腔内の健康状態の評価は身体検査や放射線検査を含む必要があります(review of systemsが意味不明で訳していません)。そのため、歯科専門職による包括的な歯科の検査をうけることは、がんによって骨吸収抑制療法をうける前の患者全てに対して賢明な方法であると考えられます。このレベルの口腔内の健康評価は、歯科専門職が行うのが最も適切です。
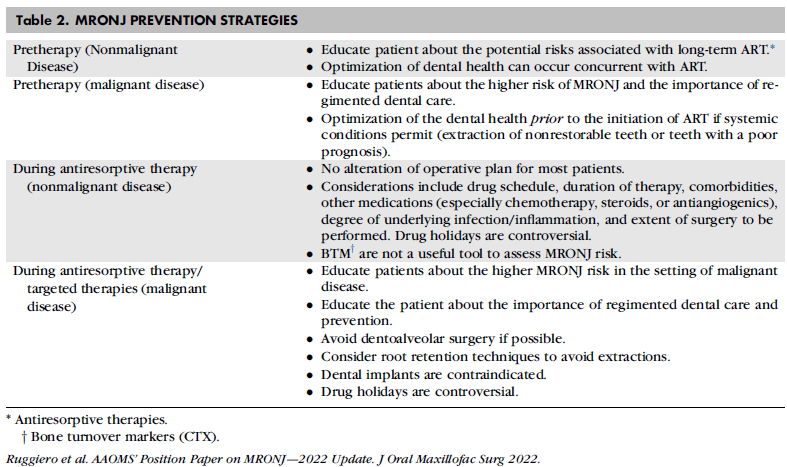
The importance of minimizing the burden of dental infection and inflammation prior to dentoalveolar surgery in this cohort of patients with an elevated MRONJ risk cannot be over-emphasized. Nonrestorable teeth and those with a poor prognosis should be extracted. Other necessary elective dentoalveolar surgery also should be completed at this time. It remains advisable that antiresorptive therapy should be delayed, if systemic conditions permit, until the surgical site(s) have mucosalized or until there is adequate osseous healing. Dental prophylaxis, caries control, conservative restorative dentistry, and nonoperative endodontic therapy are critical to maintaining functionally sound teeth. This level of care must be continued on a frequent and indefinite basis.
The posterior lingual plate region is a common site for trauma and mucosal irritation in denture wearers. Therefore, patients with full or partial dentures should be examined for areas of mucosal trauma, especially along the lingual flange region. It also is critical that patients be educated as to the importance of dental hygiene and regular dental evaluations, and specifically instructed to report any pain, swelling, or exposed bone.
MRONJリスクが上昇しているこの患者集団において、歯槽部の外科手術前に感染と炎症を最小化しておく重要性はいくら強調してもしすぎることはありません。保存不可の歯や予後が見込めない歯は抜歯するべきです。他の必要と判断された外科処置もこの時点で終わらせるべきです。全身状態が許せば、外科処置を行った部位が粘膜で被覆されるか骨が適切に治癒するまで、骨吸収抑制療法を延期するべきです。予防処置、カリエスコントロール、保存処置、非外科の歯内療法は機能的に健全な歯を維持するのに必要です。このレベルのケアは頻繁に、かつ無期限に継続しなければなりません。
義歯装着者では、下顎臼歯部舌側の口腔底あたりに傷や粘膜への刺激がよく認められます。そのため、義歯装着者の特に舌側床縁部の粘膜に傷がないかを確認する必要があります。患者には口腔内の衛生状態と定期的な受診の重要性を教育しておかなければいけません。特に痛み、腫脹、骨露出があれば報告するように指導します。
Patients scheduled to initiate antiresorptive treatment for osteoporosis(骨粗鬆症で骨吸収抑制療法を開始する予定)
Patients who are scheduled to receive antiresorptive therapy for the prevention of fragility fractures assume a significantly lower risk of MRONJ. Therefore, the urgency and the timing of optimizing the dental health are not as crucial. However, at the initiation of treatment, it would be prudent to educate patients regarding the potential risks of MRONJ. The importance of optimizing dental health throughout this treatment period and beyond cannot be underestimated.
It is not uncommon for patients to seek the consultation of an oral and maxillofacial surgeon in guiding their decision about starting or continuing antiresorptive therapy. In this scenario, the consulting oral and maxillofacial surgeon should use this opportunity to place the risks and benefits into the proper perspective. More specifically, patients should be reminded of the benefits associated with antiresorptive therapies in preventing fragility fractures and an acknowledgment of the rare occurrence of MRONJ.
病的骨折を予防する目的で骨吸収抑制療法を受ける予定の患者さんのMRONJ発症リスクは、顕著に低いと考えられます。そのため、口腔内の健康を最適化する緊急性やタイミングは、それほど重要ではありません。しかし、治療開始時にMRONJリスクに関して教育することは重要です。この治療期間とそれ以降を通じて、口腔内の健康を最適化することの重要性は、決して軽視できるものではありません。
骨吸収抑制療法を始める、または継続する決定をするのに口腔外科医とのコンサルテーションを希望することは患者にとって当たり前の事です。このシナリオでは、コンサルテーションを行う口腔外科医は、この機会を利用して、リスクとベネフィットを適切な観点で考える必要があります。特に、病的骨折を予防するための骨吸収抑制療法の利点と、MRONJがかなり希であるということを患者に認識させるべきです。
The initial enthusiasm and attention associated with the discovery of MRONJ have had unintended consequences. When initially described, a ‘‘class effect’’ was observed, suggesting that MRONJ rates for patients receiving oncologic doses of BPs and those receiving osteoporotic doses of BPs were similar. A plateau and a decline in the use of BPs for osteoporosis was noted in 2006 and is hypothesized to be associated with various safety concerns, such as MRONJ. Patients are becoming increasingly more reluctant to begin or comply with their antiresorptive therapy. Current evidence also confirms an increase in fragility fractures with significant associated morbidity. As one salient example, hip fracture rates in the United States declined each year from 2002 to 2012 and then plateaued at levels higher than projected for 2013 to 2015, attributable to an ‘‘osteoporosis treatment gap.’’ Hip fracture carries significant morbidity, with only 40 percent to 60 percent of individuals recovering their prefracture level of mobility and ability to perform instrumental activities of daily living. These data are representative of a true health crisis. The documented risk for developing MRONJ is low; however, the patient-perceived risk is not. As such, patients are unwilling to start or continue antiresorptive medical therapy. Patients are irrationally denying themselves the tangible therapeutic benefit of antiresorptive therapy to minimize the risk of fragility fractures in order to prevent a minuscule risk of developing MRONJ.
It is clear the benefit of fracture prevention outweighs the risk of MRONJ development in osteoporotic patients. This benefit is even more favorable in the cancer population where bone-stabilizing medications significantly improve quality of life, and it is detrimental when antiresorptives are withheld due to MRONJ safety concerns.
MRONJの発見に伴う最初の熱狂と注目は、意図しない結果を招きました。当初、「クラスエフェクト(注:個別の薬剤で薬効が異なることなく、薬剤全般に共通する効果)」が認められ、腫瘍に対する用量のBP製剤を投与された患者と骨粗鬆症に対する用量のBP製剤を投与された患者のMRONJ率は同程度であることが示唆されました。2006年に骨粗鬆症に対するBP製剤の使用は頭打ちから減少になり、MRONJのような様々な安全性の懸念と関連していると推測されます。患者は骨吸収抑制療法を始めることに抵抗感を覚えるようになっています。現在のエビデンスでは、病的骨折の増加はは死亡率と有意に関連する事が明確になっています。顕著な例として、アメリカでの大腿骨近位部骨折の有病率は2002年から2012年の間は減少しましたが、2013年~2015年の予測値よりも高い水準で停滞しています。これは骨粗鬆症の治療ギャップ(骨吸収抑制療法しない人が増えている)によるものと考えられます。大腿骨近位部骨折は高い死亡率と関連します。40~60%ぐらいの人しか骨折前の運動能力やADLに回復しません。これらのデータは真の健康危機を示しています。MRONJが起こるリスクは低いですが、患者自身が感じるリスクはそうではありません。患者はイヤイヤ骨吸収療法を始めたり続けたりしているのです。MRONJのわずかなリスクのために病的骨折リスクを最小化する骨吸収抑制療法を否定するのは、患者にとって不合理な事です。
骨粗鬆症患者において、骨折予防のベネフィットはMRONJリスクを上回る事は確かです。このベネフィットはQOLを改善する骨安定化治療を受けているがん患者にはさらに有効です。MRONJの懸念のために骨吸収抑制薬が投与されない事は有害です。
Asymptomatic patients receiving antiresorptive therapies for cancer(骨吸収抑制療法をうけていて無症状のがん患者)
Maintaining good oral hygiene and dental care is of paramount importance in preventing dental disease that may require eventual extractions or other dentoalveolar surgery. Procedures that involve direct osseous injury should be avoided if possible. If a dentoalveolar surgical procedure is unavoidable (eg, fractured tooth, advanced periodontal disease), patients should be informed of the associated risks. The benefit of a drug holiday remains unsubstantiated in this setting. Nonrestorable teeth may be treated by removal of the crowns and endodontic treatment of the remaining roots. Teeth may be extracted if necessary. Placement of dental implants should be avoided in the oncology patient receiving parenteral antiresorptive therapy or antiangiogenic medications. Case series and systematic reviews have reported necrosis associated with antiresorptive therapy and implant placement.
偶発的な抜歯や外科処置が必要になるかもしれない疾患を予防するために、口腔衛生状態をよく保ち歯科のケアを受ける事が最重要です。骨に直接傷をつけるような処置は、可能な限り避けるべきです。もし、歯根破折や進行した歯周病などで歯槽部の外科処置が不可避の場合、患者はリスクについてしっかり説明されないといけません。休薬のベネフィットは実証されていません。修復できない歯はクラウンを除去して根管処置が行われるかもしれません。必要なら抜歯するかもしれません。インプラント治療は非経口で骨吸収抑制療法または血管新生抑制薬投与されているがん患者には避けるべきです。症例報告とシステマティックレビューで骨吸収抑制療法とインプラント治療に感染した骨壊死が報告されています。
Asymptomatic patients receiving antiresorptive therapy for osteoporosis(骨吸収抑制療法をうけていて無症状の骨粗鬆症患者)
Since the 2014 position paper, epidemiologic data regarding the risk of MRONJ in patients receiving antiresorptive therapy for osteoporosis remain limited due to the lack of sound prospective studies with sufficient power. Nevertheless, the risk for developing MRONJ is between 0.02 percent and 0.04 percent for BPs and 0.3 percent for DMB. (see Table 1). Sound recommendations based on strong clinical research design are still lacking for patients taking oral BPs.
In general, elective dentoalveolar surgery does not appear to be contraindicated in this group. Risk assessment for the development of MRONJ in these patients includes the above-stated data and the discussion above related to drug holidays.
2014年のポジションペーパー以来、骨粗鬆症で骨吸収抑制療法を受けている患者のMRONJリスクに関する疫学データは、十分なパワーを持った縦断研究が不足しており、限定的のままです。しかし、MRONJのリスクはBP製剤で0.02~0.04%、デノスマブで0.3%とされています(表1)。経口でBP製剤を服用している患者に対しては、強力な臨床研究デザインに基づく確かな推奨がまだなされていないのが現状です。
一般的に、選択的な歯槽部の手術はこの集団では禁忌ではありません。これらの患者のMRONJのリスクアセスメントには、上記のデータおよび休薬期間に関する議論が含まれます。
The placement of dental implants in the context of antiresorptive therapy for osteoporosis continues to be an area of research interest. Several systematic reviews have acknowledged the lack of quality data and randomized clinical trials. Some studies have recommended caution, especially with a longer duration of therapy or steroid use. For example, in their systematic review, Granate et al, identified several studies that reported an elevated MRONJ risk associated with implants placed in the posterior jaw if the duration of bisphosphonate therapy exceeded 3 years and if the patients were receiving systemic corticosteroids. In contrast to these studies, systematic reviews by Gelazius et al, and Stavropoulos et al, reported no increase in risk. A recent retrospective propensitymatched cohort study of 44,900 patients reported a decreased risk of ONJ in osteoporosis patients receiving implants compared to matched controls who did not have implants. Of note, 9,738 patients had a history of BP use, and the results for implants was in contrast to risk increase for patients who underwent tooth extraction.
骨粗鬆症患者で骨吸収抑制療法を行っている患者へのインプラント治療は引き続き研究対象です。いくつかのシステマティックレビューはデータの質が低い、ランダム化比較試験がないなどを認めています。長期の骨吸収抑制療法、ステロイドの使用は特に注意が必要である事が報告されています。Granateらによるシステマティックレビューでは、3年を超えるBP製剤の投与もしくはステロイドが投与されている場合、臼歯部にインプラント埋入するとMRONJリスクが上昇すると報告している研究がいくつかあります。反対に、Gelaziusら、Stavropoulosらによるシステマティックレビューでは、リスクが増加しなかったと報告しています。44,900人の患者を対象とした最近の縦断傾向一致コホート研究では、インプラントを受けた骨粗鬆症患者のONJのリスクは、インプラントを受けなかった対照群と比較して減少していることが報告されています。注目すべきは、BP製剤投与歴のある9,738人の患者において、インプラントの結果は抜歯後のリスク上昇と対照的であったことである。
Reports of implant-related (MRONJ) necrosis can be divided into the early (implant surgery-triggered) or late (implant presence-triggered) category. In these reviews, the majority of the implant-related necrosis were not related to the initial implant surgery but occurred late (>12 months) and often at sites where implants were placed prior to the initiation of bisphosphonate therapy. The common presentation was an en bloc failure, where the osseointegration of the implants is maintained within the sequestrum. This has been recognized as a separate pattern of failure that is distinct from the common peri-implantitis failure and considered by some to be pathognomonic of MRONJ. Although there are no prospective studies or systematic reviews pertaining to implant-related necrosis associated with RANKL inhibitors or other targeted therapies, AAOMS considers this to have a similar level of risk.
In summary, robust data do not exist, and available data are conflicting. Therefore, AAOMS suggests that if dental implants are placed, informed consent should be provided to include the low risk of MRONJ, as well as early and late implant failure. These patients should be placed on a regular long-term recall schedule.
インプラントによる骨壊死は、大きく分けて埋入時の外科処置がトリガーになる早期と、インプラントがそこに存在していることがトリガーになる後期に分類されます。メインはインプラント埋入後12か月以上経過した後期であり、BP製剤開始前にインプラント治療がされていました。よく見られるのが、インプラントのオッセオインテグレーションが腐骨内で維持される失敗例です。これは、一般的なインプラント周囲炎による不具合とは別のパターンとして認識されており、MRONJの予兆と考える人もいるようです。RANKL抑制薬、または他の標的薬に関連するインプラント関連顎骨壊死についの縦断研究やシステマティックレビューはありませんが、AAOMSはBP製剤と同等のリスクと考えています。
まとめると、しっかりしたデータが存在しておらず、利用できるデータは一貫していません。そのため、もしインプラントを埋入するならば、MRONJの低いリスクと同様に、早期および後期のインプラント失敗を含むインフォームドコンセントを提供することをAAOMSは提案しています。これらの患者には、定期的に長期のリコールスケジュールを組む必要があります。
Treatment Strategies(治療戦略)
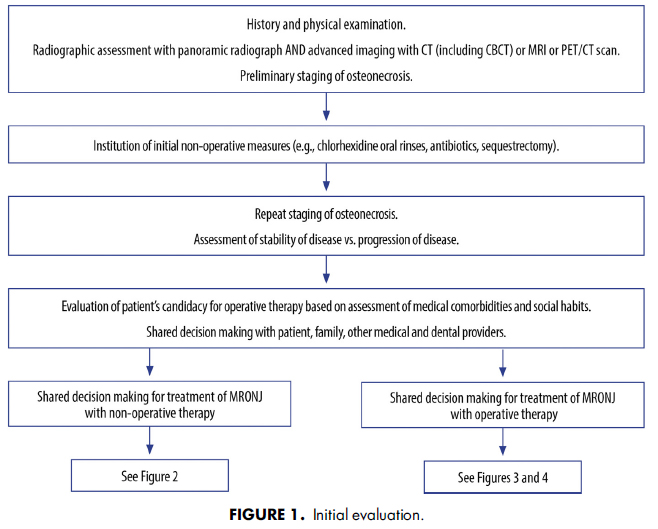
AAOMS has developed a series of treatment algorithms to streamline the evaluation (Fig 1) and management strategies (Figs 2-4) for patients with MRONJ. These strategies are based on a current review of nonoperative and operative therapies and their associated outcomes. Emphasis is placed on both nonoperative and operative management being acceptable for all stages of disease based on surgical judgment and patient factors in a shared decisionmaking model.
AAOMSはMRONJ患者の評価(図1)と管理戦略(図2~4)を合理化するために治療アルゴリスムをアップデートしました。これらの戦略は、非外科処置、外科処置とそれらの関連する結果についての最新のレビューに基づいています。手術の判断と患者要因に基づき、非外科処置と外科処置の両方があらゆる病期で受け入れられることを重視し、shared decisionmakingモデルとしています。
Nonoperative therapy(非外科処置)
The efficacy of nonoperative therapies in the management of MRONJ is documented in the literature and provides a useful adjunct to the spectrum of management strategies that also include operative treatment (Fig 2). Nonoperative strategies can be useful in all stages, especially where significant comorbidities preclude operative treatment. They may also result in stabilization of disease or cure in earlier stages. The goal of both operative and nonoperative therapies remains the same: curative therapy and quality-of-life improvement. Nonoperative therapy heavily focuses on patient education, reassurance, control of pain, and control of secondary infection to allow for sequestration of the exposed, necrotic bone.
Decisions on operative versus nonoperative therapy should be patient-specific and tailored to individual needs. The risk versus benefit ratio (including quality of life with their current symptomology), ability to performgood wound care to prevent infection and disease spread, morbidity from a major surgical procedure, as well as oral function or dental rehabilitation after marginal or segmental resection should be considered. Radiographic imaging is of utmost importance in the evaluation of MRONJ lesions. Threedimensional imaging can identify forming or fully formed sequestra and potentially decrease the invasiveness of a surgical procedure. Maintenance of maxillary or mandibular integrity is desirable, as the reconstruction of surgical defects in this population can be challenging.
MRONJ管理における非外科処置の効果は文献に記載されており、外科処置も含む様々な管理戦略の補助として有用です(図2)。非外科処置はどのステージにも有用で、特に重い合併症で外科処置ができない場合に有用です。早期のステージでは、MRONJの安定化または治癒が可能かもしれません。外科処置、非外科処置両方のゴールは同じで根治療法とQOLの改善です。非外科処置は患者の教育、安心感、痛みのコントロール、二次感染のコントロールに重点を置き、露出した壊死した骨の隔離を可能にします。
外科か非外科かの決定は患者のニーズに合わせて1人1人決めなければいけません。(現在の症状によるQOLを含めた)リスクとベネフィットの割合、感染と病巣拡大を防止するための良好な創傷ケアを行う能力、大きな外科処置による罹患、さらに辺縁切除や区域切除後の口腔機能や歯のリハビリテーションを考慮する必要があります。放射線画像はMRONJの領域評価に最も重要です。3次元画像は形成中、または形成された腐骨を確認することができ、外科的侵襲を減少させる可能性があります。このような患者さんの外科的欠損の再建は困難であるため、上顎または下顎の完全性を維持することが望まれます。
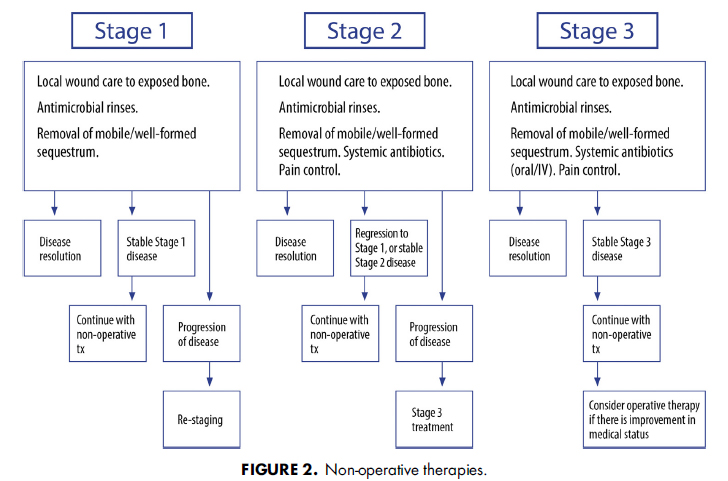
Stage 1 patients can be managed with chlorhexidine wound care and improved oral hygiene to remove the biofilm from the necrotic bone surface. Surgery may not be indicated in the absence of disease progression, with patient adequate quality of life. Stage 2 patients may struggle with local wound care and may require antibiotics for symptom control. Those patients who remain refractory to nonoperative treatment or those patients who cannot maintain adequate hygiene may benefit from operative therapy. In the presence of developing or established bony sequestra, nonoperative therapy may be indicated to allow for ultimate sequestrectomy. Exfoliation of the exposed, necrotic bone will often result in disease resolution. Therefore, for those patients with Stage 2 or 3 diseases who are poor surgical candidates, nonoperative therapies may be indicated (Fig 2).
ステージ1の患者には、クロルヘキシジンによる創傷のケアと壊死骨表面のバイオフィルム除去のための口腔衛生状態の改善で管理していきます。患者のQOLが問題なくMRONJの進行がなければ、外科処置はお勧めできません。ステージ2では、患者は限局的な創傷ケアと格闘し、症状コントロールのために抗菌薬が必要かもしれません。非外科処置では難治性だったり、十分な衛生状態を維持できない患者は外科処置が必要かもしれません。腐骨が存在したり、大きくなっている場合、非外科処置は腐骨を分離するためにお勧めできるかもしれません。露出した壊死骨の剥離はMRONJの解決に至ることも多いです。そのため、ステージ2または3で外科処置が適応にならない場合は非外科処置が推奨されます(図2)。
There is little evidence to suggest that the use of adjunctive therapies, such as hyperbaric oxygen or ozone therapy, can lead to MRONJ resolution. Larger studies and controlled trials have yet to demonstrate the efficacy of the aforementioned treatments. Therefore, these therapies should not be recommended as a mainstay of treatment at this time.
The use of vitamin E and pentoxifylline as an adjunct to standard MRONJ therapies have been reported only in case studies. A randomized, prospective, placebocontrolled trial of vitamin E and pentoxifylline is underway and will provide additional information about this treatment modality. Teriparatide, one of the few anabolic agents used for the treatment of osteoporosis, also has shown promise as an adjunct for the treatment of MRONJ in osteoporotic patients.
高濃度酸素やオゾンといった補助的な治療がMRONJの解決に効果的であるというエビデンスはほぼありません。これらの治療の有効性を検討する大規模でコントロールされた研究は今後行われるでしょう。そのため、現時点ではこれらの治療はお勧めできません。
MRONJの標準治療の補助としてのビタミンEとペントキシフィリンの使用は、症例報告しかされていません。ビタミンEとペントキシフィリンのランダマイズ、縦断、プラセボコントロール研究が現在行われており、今後新たな知見が得られることでしょう。テリパラチドは骨粗鬆症の治療に用いられる同化剤の1つですが、骨粗鬆症患者のMRONJの治療補助薬としても有望視されています。
Operative therapy(外科処置)
While nonoperative therapy continues to be a treatment option for MRONJ, operative therapy is increasingly reported as a viable option with high success rates for all stages of the disease (Figs 3 and 4). Numerous reports have identified high success rates associated with resection of MRONJ lesions. Importantly, one must consider that MRONJ may progress over time, albeit in an unpredictable manner. Furthermore, adopting a nonoperative approach to MRONJ does not uniformly result in sequestration of the exposed necrotic bone with disease resolution. Thus, operative intervention should be explored and presented as a treatment option in an attempt to reduce the progression of disease with the recognition that early surgical intervention can predict beneficial patient outcomes.
非外科処置はMRONJの治療オプションとして継続される一方で、外科処置は全てのステージにおいて高い成功率を示す、実行可能なオプションとして報告される事が増えています(図3,4)。MRONJ領域の切除に関して、多くの研究で高い成功率が報告されています。重要なのは、予測不可能ではありますが、時間と共にMRONJが進行する可能性があることを考慮しなければいけません。さらに、非外科処置によりMRONJが解決する露出壊死骨の分離に至るとは限りません。そのため、早期の外科的な介入は患者の有益な転帰を予見しやすいという認識で、MRONJの進行を抑制するための治療オプションとして外科的な介入を検討、提示する必要があります。
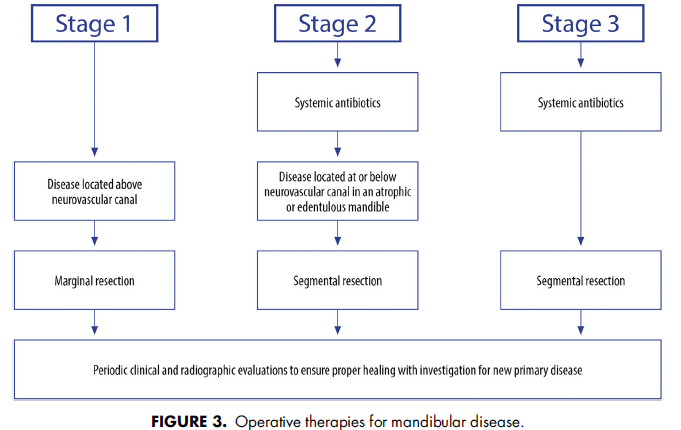
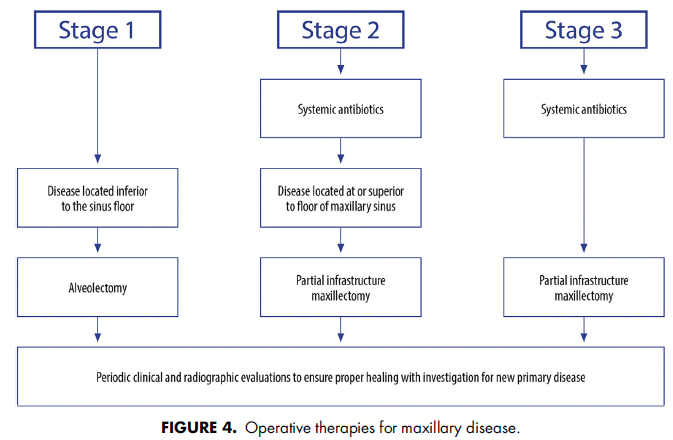
Segmental or marginal resection of the mandible and partial maxillectomy are effective methods to control MRONJ. This approach can be applied to patients with all stages of MRONJ, including Stage 1 disease. These resections require margins beyond the borders of the necrotic bone to an area of vital, bleeding bone. Additional reports have identified success when surgical resection of MRONJ was performed by experienced surgeons. Consistent with surgical principles, control of comorbid conditions is paramount in managing MRONJ. Physiologically compromised patients, such as those with an increasing burden of distant metastatic disease, may not respond favorably to resection of their osteonecrotic jaw, and may occasionally develop refractory disease. Finally, surgical resection for MRONJ in patients with metastatic cancer may identify metastases in the jaw specimen, albeit in a minority of patients.
下顎の区域、辺縁切除と上顎骨部分切除はMRONJをコントロールするための有効な方法です。この方法はステージ1を含むMRONJの全てのステージに適応できます。これらの切除療法は、壊死骨からマージンを取って健全な骨エリアまで切除する必要があります。加えて、経験豊富な外科医が切除を行った場合の成功例も報告されています。外科処置の原則と同様に、基礎疾患のコントロールはMRONJの管理に最も重要です。遠隔転移の負担が増加しているような生理的な負担の大きい患者は、壊死骨の切除によい反応を示さず、難治性になってしまう可能性があります。最終的に、転移がんを有する患者の外科的切除では、少数ですが、顎骨内の転移を認める事があります。
Active clinical and radiographic surveillance is critical in the nonoperative management of patients with Stage 1, 2, and 3 diseases to monitor for signs of disease progression. In patients who demonstrate the failure of nonoperative therapy, early operative intervention is recommended. In patients with a progressive clinical or radiographic disease or more advanced disease at presentation, surgical resection of MRONJ should be performed without first instituting prolonged nonoperative measures. MRONJ represents a complex wound whereby operative therapy can be performed in a timely fashion. Although controversy between operative and nonoperative therapies exist, operative treatment of patients has demonstrated maintenance of mucosal coverage, improved quality of life, and expedient resumption of antiresorptive therapy for all stages of MRONJ disease. The benefit of drug holidays for the operative intervention of MRONJ has not been substantiated.
MRONJの進行をモニターするため、ステージ1,2,3の患者の非外科的処置の管理時に臨床的なチェック、放射線画像のチェックは絶対に必要です。非外科的処置が失敗した患者においては早期の外科的介入が推奨されます。臨床的、放射画像的に進行が認められる場合、まず長期的な非手術的措置を講じることなく、MRONJの外科的切除を行う必要があります。MRONJは複雑な創傷を示すので、外科的処置をタイムリーに行うことが可能です。外科的処置と非外科的処置の間に論争がありますが、外科的処置は粘膜の被覆維持、QOL改善、骨吸収抑制療法の迅速な再開を実証しています。外科的介入時の休薬の有効性は実証されていません。
Future Research
AAOMS realizes that MRONJ is a complex disease process with a multifactorial etiology for which many questions remain unanswered. Continued preclinical and clinical data are required, especially in the form of prospective studies. Continued research efforts and the outcomes that result should be considered the foundation upon which recommendations are developed that will guide patients and providers. While the data supporting the conclusion that antiresorptives represent genuine risk factors are robust, this is not the case for other classifications of medications (eg, antiangiogenics, corticosteroids, immune modulators). Published studies have reported a relationship of certain dosing practices (eg, transition from BPs to DMB) or a synergistic effect between antiresorptive medications and antiangiogenic medication with a risk of MRONJ. These associations, however, are based on case reports and small case series. It also has been hypothesized that the total exposure to an antiresorptive medication is a risk factor for developing MRONJ. However, this has been difficult to demonstrate, possibly as a result of not having a good measure of exposure other than years of treatment. Similar to the cancer risk associated with tobacco use (eg, pack/ years), the antiresorptive exposure risk MRONJ may be better defined as a cumulative dose load (eg, mg equivalent of BP/years of exposure) that would account for risk associated with different medications and dosing schedules over time. Dosereduction protocols and individualized strategies for antiresorptive therapy in long-term cancer survivors with a metastatic bone disease are being explored. It remains to be determined if these protocols will reduce the risk of MRONJ in this patient cohort. AAOMS acknowledges the challenge of elucidating potential risks associated with non-antiresorptive therapies, alone or in combination with antiresorptive medications, and therefore considers it imperative that research efforts continue in the form of prospective studies.
A review of the current literature also failed to provide sound data in the form of randomized, controlled trials that would establish the effectiveness of biomarkers and drug holidays or validate a risk relationship with genetic markers and MRONJ. Until these relationships are established or refuted, AAOMS considers it prudent to recognize that these factors may play a role in the development and management of MRONJ.
AAOMSは、MRONJは多要因性の複雑な疾患であり、多くの疑問にいまだ答えられないということを認識しています。非臨床試験、臨床試験共にさらにデータが必要です。特に縦断研究が必要です。継続的な研究努力とその結果は、患者さんと医療従事者の指針となる勧告を作成するための基盤となるものと考えるべきです。骨吸収抑制薬は真のリスクファクターであるという結論を支持する強いエビデンスがありますが、血管新生抑制薬や副腎皮質ホルモン、免疫調整薬などの他の薬剤はそうではありません。発表された研究では、特定の投与方法(例えば、BP製剤からデノスマブへの移行)、または、骨吸収抑制薬と血管新生抑制薬の相乗効果とMRONJリスクとの関連が報告されています。これらの関連は症例報告または規模が小さい研究に基づいています。骨吸収抑制薬の投与量の総量が、MRONJ発症のリスク因子であるという仮説もあります。しかし、投薬期間以外のよい指標がなく、それを実証するのは難しいです。喫煙(箱/年)とがんリスクの関連と同様に、骨吸収抑制薬への暴露リスクによるMRONJも、長期にわたって異なる薬物および投与スケジュールに関連するリスクを考慮した累積的な投与量負荷(mg/年)で規定するのが良いかもしれません。骨メタを伴う長期がんサバイバーへの骨吸収抑制療法のための、減量プロトコールおよび個別化戦略が検討されています。これらのプロトコールが長期がんサバイバー達のMRONJを下げるかどうかはまだ検討中です。AAOMSは、骨吸収抑制療法未実施、骨吸収抑制薬単独、併用時の潜在的なリスクを解明する課題を認識しており、縦断研究の形で研究努力を継続することが不可欠であると考えています。
最近の研究のレビューをしても、バイオマーカーや休薬の有効性を立証したり、遺伝マーカーとMRONJリスクの関連を検討するランダマイズ、コントロールされたデータはありませんでした。これらの関連性が確立する、または否定されるまで、AAOMSは、これらの因子がMRONJの発生や管理に果たす役割に慎重な立場を取ります。
終わりに
かなり英語が難しかったので、誤訳が結構あるかもしれません。もしお気づきの場合はコメントに記載していただけますと幸いです。また、1週間程度かけて読んでいますので、最初と最後で単語や文章にゆらぎが認められる可能性がありますが、もう見返す余力がないのでそのまま公開しました(苦笑)。









Comment
https://hc.nikkan-gendai.com/articles/278534?page=4
日刊ゲンダイにこんなことが書かれています。
ゲンダイだからなあ‥
ポジションペーパーをふまえ、個人的にはデノスマブは休薬するメリットがあるかもしれないが(休薬できるかは別として)、BPは休薬は必要ないと思いますがいかがでしょうか?
匿名さん
コメントありがとうございます。
骨粗鬆症に用いるのであれば基本的には低用量なので、DMBもBPも休薬は必要ないと考えます。
口腔外科学会の総説でもそのようなコンセンサスになっています。
https://www.dentist-oda.com/mronj_2020sosetsu/
プラリアに関しては第一三共のサイトにもわざわざ載せています。
https://www.medicalcommunity.jp/products/faq/pralia_691
プラリアは半年に1度の頻度が多いと思うので、自分は打って3~4か月ぐらいにまとめて外科処置を行う事が多いです。
ご参考になりましたら幸いです。