PEEKの特性と歯科応用の可能性(2016年時点)

突如として12月1日からPEEK冠が保険適応になりました。PEEKという材料は以前から聞いた事はあったものの、ではどういう物性なのかということは全く理解していません。これでは、患者さんにお勧めできるものなのかもわからないので、論文を読んでいくことにしました。当面はブロックが品薄すぎてオーダーがあっても出来ない、と技工所の方から言われているので、実際に扱えるのはもう少し後になるでしょうから、やや余裕があります。
今回の論文は2016年にJPRに掲載されたもので、7年ほど前になります。この時点でどれだけのものだったかということをまず理解したいと思います。なお、この論文は補綴学会のPEEK冠に関する基本的な考え方(第1報)というPDFにも引用されているものになります。
Applications of polyetheretherketone (PEEK) in oral implantology and prosthodontics
Shariq Najeeb , Muhammad S Zafar , Zohaib Khurshid , Fahad Siddiqui
J Prosthodont Res. 2016 Jan;60(1):12-9. doi: 10.1016/j.jpor.2015.10.001.
PMID: 26520679
https://pubmed.ncbi.nlm.nih.gov/26520679/
JPRがJstageに移行したので、ダウンロードがフリーになりました。
https://www.jstage.jst.go.jp/article/jpr/60/1/60_12/_pdf/-char/en
Abstract
Purpose: Polyetheretherketone (PEEK) is a polymer that has many potential uses in dentistry. The aim of this review was to summarize the outcome of research conducted on the material for dental applications. In addition, future prospects of PEEK in the field of clinical dentistry have been highlighted.
Study selection: An electronic search was carried out via the PubMed (Medline) database using keywords ‘polyetheretherketone’, ‘dental’ and ‘dentistry’ in combination. Original research papers published in English language in last fifteen year were considered. The studies relevant to our review were critically analyzed and summarized.
Results: PEEK has been explored for a number of applications for clinical dentistry. For example, PEEK dental implants have exhibited lesser stress shielding compared to titanium dental implants due to closer match of mechanical properties of PEEK and bone. PEEK is a promising material for a number of removable and fixed prosthesis. Furthermore, recent studies have focused improving the bioactivity of PEEK implants at the nanoscale.
Conclusion: Considering mechanical and physical properties similar to bone, PEEK can be used in many areas of dentistry. Improving the bioactivity of PEEK dental implants without compromising their mechanical properties is a major challenge. Further modifications and improving the material properties may increase its applications in clinical dentistry.
目的:PEEKは歯科において様々な可能性があるポリマーです。本レビューの目的は、歯科への応用についての研究結果を要約することです。加えて、PEEKの歯科臨床の将来展望について強調しました。
研究の選択:PubMedにて検索を行い、過去15年以内に英語で書かれた原著をピックアップしました。本レビューに関連した研究を解析要約しました。
結果:PEEKは様々な臨床応用の試みが行われてきました。例えば、PEEKインプラントはPEEKと骨間の機械的特性が近似していることからチタン製フィクスチャーよりもストレスシールド(インプラントによって骨から典型的なストレスが除去された結果として生じる骨密度の減少)が少ないと報告されています。PEEKは可撤式、固定式補綴物において有望な材料です。さらに、最近の研究では、ナノスケールにおいてPEEKインプラントの生物活性の改良がフォーカスされています。
結論:機械的、物理的物性は骨に近いと考えられるため、PEEKは歯科の幅広い領域で使用できる可能性があります。機械的特性を損なわないPEEKインプラントの生物活性の改良は大きなチャレンジです。さらなる材料特性の改善、改良により歯科臨床における応用は増えるかもしれません。
ここからはいつもの通り本文を適当に抽出して意訳要約します。誤訳もあり得ますので、気になったら実際の本文をご確認ください
緒言
芳香族ポリエーテルケトン(PEEK)は合成、歯牙色である重合体であり、整形外科領域で長年バイオマテリアルとして使用されてきました。エーテルエーテルケトンモノマー(図1)のモノマーユニットは、ビスフェノールの段階成長ジアルキル化反応によって重合し、ポリエーテルエーテルケトンを形成します。PEEKの一般的な合成経路は、4,4’-ジフルオロベンゾフェノンとヒドロキノンの二ナトリウム塩を、ジフェニルスルホンなどの極性溶媒中で300 ℃で反応させるものです。融点が335度付近にある半結晶の物質です。PEEKはは、官能化モノマーの添加(プレポリマー化)またはスルホン化、アミノ化、ニトロ化などの化学プロセスによるポストポリマー化によって改質することができます。
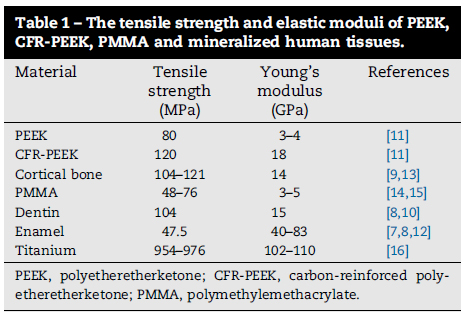
PEEKが整形外科のインプラントに応用される大きな利点は、人の骨に近い小さい弾性係数(3~4GPa)を有していることです。PEEKは他の物質と合わせる事で簡単に改変できます。例えば、カーボンファイバーを合わせることで、弾性係数を18GPaまで大きくする事ができます。チタンとその合金は骨よりもはるかに大きな弾性係数を有しており、結果として深刻なストレスシールドが起こります。カーボンで補強されたPEEKの弾性係数は、皮質骨と象牙質と同等レベルであり、インプラント材として使用した際、チタンと比較してストレスシールドが少ない事が分かっています(表1)。さらに、PEEKの引っ張り特性も、骨、エナメル、象牙質と類似しており、修復材料として適した性質を有しています。
チタンと対照的に、PEEKの骨伝導特性は非常に限定的です。従って、多くの研究がPEEKインプラントの生物活性の改良を試みてきました。提案された方法として、骨誘導ハイドロキシアパタイトをコーティングしたPEEK、表面粗さの増加と化学修飾、生物活性粒子の挿入などがあります。PEEKは白色で素晴らしい機械的特性を有しているので、例えば固定性、着脱式補綴装置への応用が提案されてきました。PEEKの表面修飾効果は、異なる合着材と抜去歯の接着で検討されてきました。PEEKの様々な歯科への応用の可能性については図2を御覧ください。さらに、PEEKは審美的な矯正ワイヤーにも使用できます。ポリエーテルスルフォンやポリフッ化ビニリデンなどの他のポリマーと比較して、PEEKワイヤーはコバルトクロム、チタンモリブデン、ニッケルチタン等と同様の断面であり、強い矯正力を付与することができます。これらのユニークな物理的、機械的特性により、PEEKは歯科にとって有望な材料です。本レビューの目的は、補綴的な応用のために行われた研究の結果を要約することです。加えて、歯科臨床分野におけるPEEKの将来展望について強調しました。
インプラントマテリアルとしてのPEEK
Wolffの法則によると、骨は加えられた荷重に応じてリモデリングします。ストレスシールドは、インプラントによる通常の荷重の防御としてインプラント周囲骨量が減少するものです。カーボンファイバー強化PEEKインプラントの有限要素解析では、チタンと比較してストレスシールドが減少する事が示唆されています。しかし、PEEKインプラントは臨床的にそれほど使用されていないので、PEEKとチタンインプラントで骨吸収が異なるかどうかは分かっていません。さらに、Sarotらによる最近の有限要素解析では、PEEKとチタンインプラント間で応力分布に差を認めなかったと報告しています。PEEKインプラントがチタンインプラントよりもストレスシールドが減少するかどうかを結論づけるために、より多くの臨床試行が必須です。
未修飾のPEEKは本質的に疎水性であり、水接触角は80~90度で生体不活性です。未修飾PEEKは、in vitroでの細胞増殖率に有意な効果を発揮しませんでした。対照的に、従来型、またはファイバー強化型PEEKでは、細胞タンパク質の代謝回転の増加が認められました。動物実験では、PEEKは局所的な炎症を引き起こしながらも、3年間は生存可能であることが示唆されています。にもかかわらず、PEEKと従来型インプラント材料であるジルコニアとチタンのオッセオインテグレーションに差がない、と示唆した研究は数多く存在します。逆に、最近のプロテオーム解析では、PEEKはmRNAのプロセシングを阻害し、表面での細胞増殖率を低下させ、長期的には細胞毒性作用が生じる可能性が指摘されています。それにもかかわらず、同じプロテオーム解析の研究では、PEEK、ジルコニア、チタンの生体不活性には有意差を認めませんでした。未修飾PEEKは生体不活性な材料であると考えられていますが、in vivoでもin vitroでもPEEKの骨誘導性の決定的なエビデンスはありません。したがって、未修飾ではPEEKインプラントの長期的な生存率は疑わしいです。
機械的、生物特性を改良するために、数多くの修飾が試されています。しかし、PEEKインプラントは歯科臨床で幅広く使用されておらず、人への長期的な有効性を推測するにはデータが不足しています。
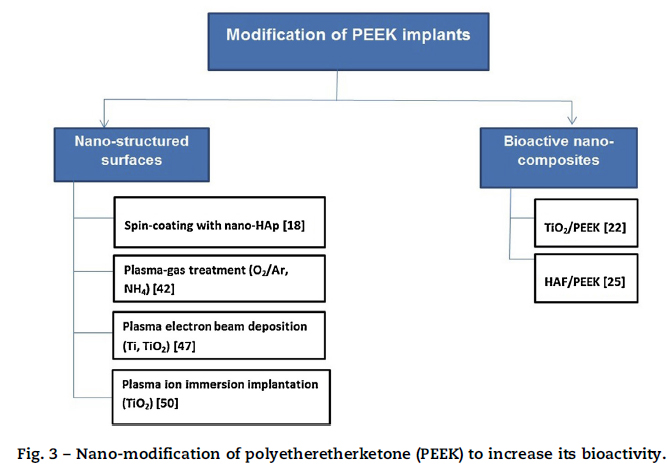
ナノ構造のPEEK表面
ナノマテリアルの歯科用途における有益な役割はよく知られています。近年、生物活性と骨誘導を改良するために、PEEKもナノレベルで修飾されています。従来、PEEKは骨誘導性のハイドロキシアパタイトカルシウムやチタンなどの生体活性剤量をプラズマ溶射によってコーティングされています。このプロセスでは、粒子をプラズマトーチでインプラント表面にスプレーします。プラズマは粒子を溶かし、インプラント表面に堆積させ、粗い表面層を形成します。生体活性層のスプレーは大きなインプラントには適していますが、比較的小さな歯科用インプラントにはコーティングは不向きかもしれません。かなりラフでとても厚いアパタイト層は、インプラントを失敗に導く剥離を起こすかもしれないからです。他の欠点として、PEEKをプラズマ溶射によりハイドロキシアパタイトをコーティングするプロセスが高温なことです。PEEKは融点が低い(340度付近)のため、高温でPEEKはダメージを負うかもしれません。さらに、グラスファイバー強化型PEEK表面へのプラズマ溶射ハイドロキシアパタイトコーティングの接着強さが弱い(2.8MPa)ので、コーティングプロセス中に高温でインプラント表面からカーボンファイバーの蒸発が起こる事が示唆されています。
PEEKへの生体活性アパタイトのナノスケールコーティング、生体活性PEEKナノコンポジットの開発に注目が集まっています。骨形成インプラントコーティングは、インプラントの表面性状を修飾することで用いられています。生体活性表面コーティングは、骨組織との相互作用を改善し、結果としてよりよいオッセオインテグレーションを獲得します。スピンコーティングはPEEK表面にうすいナノスケールハイドロキシアパタイトカルシウム層をコーティングする他の方法です。このプロセスでは、溶媒中で溶かされたアパタイトは、高速回転しているインプラント表面にゆっくりと落下します。熱処理により、ハイドロキシアパタイトの薄い層がインプラント上に形成されます。動物実験では、スピンコーティングPEEKインプラントは、コーティングなしPEEKと比較して強固な骨インプラント接触であることが報告されています。しかし、除去トルクにおいて有意差は認められませんでした。また、ナノスケールコーティングは、プラズマガスエッチングでも可能です。このプロセスでは、低圧ガスを用いてPEEKインプラントの表面にナノレベルの表面粗さと官能基を導入し、より優れた材料-組織相互作用のための親水性を誘導します。in vitroでのガスプラズマPEEKインプラントの評価では、細胞増殖の促進とインプラント表面の間葉系細胞の分化を認めました。しかし、低圧酸素プラズマPEEKを兎の骨に埋入した場合、骨インプラント接触で非修飾PEEKとの有意差を認めませんでした。
最近、Nkaharaらはヒツジにカーボンファイバー強化PEEKを股関節ステムインプラントしました。カーボンファイバー強化PEEK股関節ステムを、酸化チタンとハイドロキシアパタイトを用いて17nm厚でプラズマ溶射、α-TCPに浸漬しました。金属イオンの放出が無く、股関節インプラントとして素晴らしい生体適合性と機械的特性だったと報告しています。加えて、ハイドロキシアパタイトコーティングPEEKインプラントでは、耐荷重用途でもセメントレスでの固定が可能でした。これらの知見は、コーティングPEEK材料は歯科インプラントにおいてもかなりのポテンシャルがあることを示唆しています。しかし、人におけるコーティングPEEKインプラントを使用した臨床研究は存在せず、まずは、臨床応用の前に生体適合性を調べる必要があります。
PEEKの生物学的、物理学的特性を改良するために、様々なナノレベルでの修飾が行われてきました(図3)。電子ビーム蒸着は、材料に電子ビームを照射することで、基板上に非常に薄い、ナノレベルの材料層を分解、蒸着します。この方法を用いてチタンコーティングされたPEEKは、親水性が増し、細胞増殖の向上が認められます。陽極酸化されたナノレベルで多孔性のチタンコーティング層は、固定化されたBMP-2を運搬することができます。BMP-2はインプラント側の骨沈着を増加させる成長因子です。チタンコーティングされた、またBMP-2をコーティングしたPEEKインプラントは魅力的で、口腔インプラントとして大きなポテンシャルがあります。しかし電子ビームコーティングインプラントはまだin vivoでテストされておらず、臨床的な展望は未だ不明です。高電圧下で粒子のプラズマ中に置かれた基板は、その材料の粒子の薄い層でコーティングされます。このプロセスはプラズマイオン注入(PIII)として知られています。PIIIにより酸化チタンコーティングしたPEEKは、Staphylococcus aureusとEschrechia coliに対して部分的な活性を有していますが、歯周病原性に対する抗菌効果はまだ明らかではありません。アパタイトコーティングPEEKインプラントと同様に、ビームコーティングPEEKインプラントも人での研究はありません。そのため、これらのインプラントは、安全性と生存期間の十分なデータが出るまでは臨床で採用しない方がよいです。
硫酸によりエッチングし、蒸留水で洗ったナノ構造のPEEK表面は、in vitroとin vivo両方で未修飾PEEKと比較してオッセオインテグレーションを加速する事が観察されています。ナノ多孔性のエッチングされた表面と硫酸による親水性の更新の相乗効果により、スルホン酸化したPEEKの生体適合性の更新が説明出来ます。しかし、in vivoでスルホン酸化したPEEKをインプラントした際に初期の骨形成が減少する事も観察されますが、これは表面に硫酸が残留している事で説明できるかもしれません。この効果は、残留した硫酸をアセトンで除去することで最小化することができます。最近の実験では、強アルカリをPEEK表面に使用してOH基を導入し、模擬生体模倣液(SBF)に浸漬した際に生体模倣アパタイト層の形成を誘導することに焦点が当てられています。しかし、従来の生体模倣コーティングは、生成に48時間かかることがあります。しかし、マイクロウエーブ補助型の生体模倣コーティングはPEEK表面にアパタイト層をわずか4分で形成できます。このアパタイトレイヤーの接着強さを調べた研究はいまだありません。コーティングの接着剥離はインプラント失敗の原因になりえるので、生体模倣コーティングしたPEEKが臨床使用に適していると判断する前に、コーティングの品質を評価する研究が必要です。
生体活性を有するPEEKナノコンポジット
生物活性を上げるために、メルトブレンドと圧縮成形技術により、PEEKに生物活性無機粒子を組み込みました。しかし、組み込んだ2~4μmの生物活性ハイドロキシアパタイト粒子はPEEKの機械的特性に悪い影響を与えます。これは、大きなサイズの代わりにナノサイズ粒子を使うことで克服できます。ナノコンポジットPEEKインプラントは、生物活性の向上や機械的特性の向上など様々な利点があります。ハイドロキシフルオロアパタイトのようなナノサイズの粒子を組み込むことで、生体内でのオッセオインテグレーションを改善するだけでなく、一般的な口腔病原体であるStreptcoccus mutansに対する抗菌性を付与することが示唆されています。さらに動物実験では、ナノ酸化チタン/PEEKインプラントは、純PEEKと比較して高い生物活性を示しました。歯科硬組織は異方性であり、その機械的特性は同じ組織内でもある地点から別の地点まで異なります。ナノコンポジットPEEKにより、研究者は、特定の用途に必要な機械的特性の組み合わせを変化させたバイオマテリアルを合成することができます。例えば、これらの生体活性ナノコンポジットは、インプラントとして使用されるだけでなく、間接的な歯冠内修復物や歯冠外修復物としても使用できます。これらの修復物は、Wangらが報告している抗菌作用を利点として有しています。しかし、このコンポジットを修復材料として使用する前に使用法と手技を確立するために多くの研究が必要です。
PEEKインプラントアバットメント
生体適合性を考慮すると、ヒーリングアバットメントはPEEK製で問題ありません。KoutouzisらによるRCTでは、チタン製アバットメントとPEEK製アバットメントでは骨吸収、軟組織の炎症に有意差を認めませんでした。さらに、PEEKに付着する口腔微生物のフローラは、チタン、ジルコニア、PMMAとほぼ同等でした。骨とPEEKの弾性係数は近似しており、ストレスシールドを軽減し、骨のリモデリングを促進します。そのため、PEEKはアバットメントとしてチタンに代わる有効な代替材料となる可能性があります。
可撤性補綴装置材料としてのPEEK
義歯をPEEKでCAD/CAMシステムを使用して製作することができます。TannousらはPEEKクラスプはコバルトクロムと比較して維持力が弱いと報告しています。しかし、この研究はin vitroで金属冠上で行われており、実際の臨床で審美的なPEEKクラスプが義歯の維持にどれだけ有効化はわかりません。他の応用としてはオブチュレーターがあります。しかし、従来のアクリルレジン製のオブチュレーターと比較したPEEKオブチュレーターの有効性を評価するために、更なる研究が必要です。現在まで、PEEKデンチャーに焦点を当てた臨床研究、システマティックレビューはありません。しかし、PEEKの優れた機械的、生物学的特性により、将来PEEKで義歯が製作されるようになっても驚きはありません。
PEEKクラウン
接着を容易にするために、PEEKの表面を調整する様々な処置が提案されています。シリカコーティングあり/なしでのエアーアブレーションは表面の濡れ性を向上し、。硫酸エッチングは、表面を粗く化学的に変化させ、疎水性レジンとの接着をより効果的にします(剪断接着強さ 19.0±3.4MPa)。60~90秒間硫酸でエッチングした場合、37度28日間水中浸漬後のレジンセメントとの剪断強さは15.3±7.2MPaでした。ピラニア溶液(硫酸と過酸化水素の混合物)でのエッチングとボンディング材の使用では、PEEK材とコンポジットレジンとの引張り強さは23.4±9.9MPaでした。PEEKクラウンと支台歯象牙質との引張り強さにおいて、エアーアブレーションと硫酸エッチングで有意差を認めませんでした。
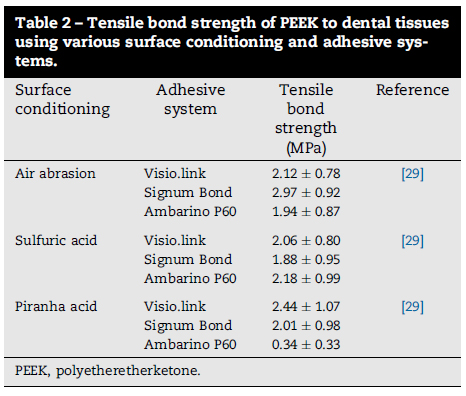
これらの研究は、PEEKがコンポジットレジン材下のコーピング材料として使用できることが示唆されました。PEEKの機械的特性が、象牙質、エナメル質と近似しているため、PEEKは金属、セラミック修復よりも利点がある可能性があります。
PEEKをミリングした固定性ブリッジ
CAD/CAMにより、チェアサイドでの補綴物の製作が可能になりました。CAD/CAMで製作したコンポジット、PMMAブリッジは、従来のブリッジよりも機械的特性が優れています。PEEKはPMMAの代替となりうる材料です。CAD/CAMで製作した3ユニットのブリッジは、プレス、ペレット状のPEEKブリッジと比較して高い破折抵抗を有する事が示唆されました。ミリングPEEKブリッジの破折抵抗は、二ケイ酸リチウム(950N)、アルミナ(851N)、ジルコニア(981~1331N)よりも大きい値を示しました。
PEEKは摩耗にも強いです。弾性率と硬さはかなり低いですが、PEEKの摩耗抵抗はメタルと同等です。しかし、実際に口腔内に装着されたPEEK冠とその他のクラウンの摩耗抵抗を比較した臨床研究はありません。そのため、PEEKが口腔内で象牙質やエナメル質と調和して機能するかどうかはわかりません。摩擦抵抗、機械的特性が優れており、前述したコンポジット、歯質への適切な接着力などを考慮すると、PEEKブリッジは満足な生存率が期待できるでしょう。
結論
機械的、物理的特性が骨と象牙質に近似しているため、PEEKはインプラントを含む歯科の様々な場面に使用できる可能性があります。機械的特性への影響無しにPEEKの生物活性を向上させるのは、大きな課題です。PEEKはアクリルレジンよりも優れた機械的特性を有しており、CAD/CAMによる固定性、可撤性補綴物においても魅力的な材料です。この材料をさらに歯科用途に応用するためには、さらなる研究と臨床試験が必要です。
まとめ
PEEKは弾性係数等がエナメル質や象牙質に近い材料で、しかも改変が容易と色々な可能性がありそうです。ただし、2016年時点ではさらなる研究が必要という文章が多く、臨床応用にはまだかなり時間がかかるという雰囲気でした。この内容を2016年に読んでいたら、まさか7年後に日本で保険適応になるなんて思わないでしょう。この7年で圧倒的な技術革新があったんでしょうか?
あくまでこの論文では「PEEKがコンポジットレジン材下のコーピング材料として使用できることが示唆された」という内容であり、クラウンとしての使用はあくまでコーピングであり、PEEKのみの単冠としての想定がされていません。ただし、ブリッジではCAD/CAMでのミリングの話が出てきており、これはPEEKのみが想定されているようです。
次は補綴学会のPEEK冠に関する基本的な考え方(第1報)にのっている2019年の以下の参考文献を読みたいのですが、ダウンロードができない・・・・。閲覧権限が・・・・。
PEEK High Performance Polymers: A Review of Properties and Clinical Applications in Prosthodontics and Restorative Dentistry. Alexakou E, Damanaki M, Zoidis P, Bakiri E, Mouzis N, Smidt G, Kourtis S. Eur J Prosthodont Restor Dent. 2019 Aug 29;27(3):113-121.








