COVID-19感染が唾液でわかる?

どうしても読みたくなった
Twitterで論文を紹介してくれていたのでこれは読むべしとダウンロードしたんですが、早めに読まないと意味がないと思うので読む事にしました。
今までの研究のレビューになります。
フリーダウンロードです。
初めて読む専門外の分野なので、うまく読めるかどうか不安です。
少し省略している所もありますがほぼ全訳です。
誤訳している可能性もありますが、今回はできるだけ原文を載せます。間違っている所をみつけたら教えてください。
なお、かなり長文です。
Saliva: potential diagnostic value and transmission of 2019-nCoV
International Journal of Oral Science volume 12,
https://www.nature.com/articles/s41368-020-0080-z.pdf

Abstract
2019-nCoV epidemic was firstly reported at late December of 2019 and has caused a global outbreak of COVID-19 now. Saliva, a biofluid largely generated from salivary glands in oral cavity, has been reported 2019-nCoV nucleic acid positive. Besides lungs, salivary glands and tongue are possibly another hosts of 2019-nCoV due to expression of ACE2. Close contact or short-range transmission of infectious saliva droplets is a primary mode for 2019-nCoV to disseminate as claimed by WHO, while long-distance saliva aerosol transmission is highly environment dependent within indoor space with aerosol-generating procedures such as dental practice. So far, no direct evidence has been found that 2019-nCoV is vital in air flow for long time. Therefore, to prevent formation of infectious saliva droplets, to thoroughly disinfect indoor air and to block acquisition of saliva droplets could slow down 2019-nCoV dissemination. This review summarizes diagnostic value of saliva for 2019-nCoV, possibly direct invasion into oral tissues, and close contact transmission of 2019-nCoV by saliva droplets, expecting to contribute to 2019-nCoV epidemic control.
2019-nCoVの流行は2019年の12月終盤に初めて報告され、世界的なアウトブレイクに至っています。唾液は口腔内に唾液腺から多量に分泌される液体であり、2019-nCoVの核酸検出陽性と報告されています。
しかも肺、唾液腺、舌はACE2の発現により2019-nCoVの新たなホストの可能性があります。感染唾液飛沫の近距離感染はWHOによって広められた2019-nCoVの主な感染経路です。一方で、長距離の唾液エアロゾル感染は室内での環境に依存します。例えば歯科治療によるエアロゾル発生などです。
いまのところ、2019-nCoVが長時間生きたまま空中を浮遊している直接的なエビデンスはありません。そのため、感染唾液飛沫の形成を防ぐ、徹底的に室内の空気を消毒する、唾液飛沫をブロックする事は2019-nCoVの感染を鎮静化する可能性があります。
このレビューは2019-nCoVの唾液診断、口腔組織へ直接侵入の可能性、唾液飛沫による近距離感染をまとめ、2019-nCoVのコントロールに貢献する事を期待するものです。
Introduction
COVID-19に関する状況と唾液に関する簡単な説明なのでパスします。
DIAGNOSTIC VALUE OF SALIVA FOR 2019-NCOV
The officially pathogen detection is the confirmation of 2019-nCoV nucleic acid from throat swabs.10 Throat swabs are relatively invasive, induce coughing and cause bleeding occasionally, which may increase risks of healthcare workers infection. Saliva stands at the entry of respiratory system and was also found 2019-nCoV nucleic acid positive. With the nature of noninvasion and less hazard to healthcare workers, saliva specimen collection has the advantages of being more acceptable for patients and more secured for healthcare workers for diagnosis of coronavirus. Till now, three approaches have been reported to collect saliva—coughing out, saliva swabs, and directly from salivary gland duct.
In two studies on coughed out saliva, 11 cases out of 12 (91.67%)11 and 20 cases out of 23 (86.96%)12 COVID-19 patients were 2019-nCoV RNA positive in saliva, respectively. In one study of saliva swabs, half of 15 (50%) COVID-19 patients were 2019-nCoV RNA positive in saliva. In one study of saliva directly from salivary gland duct, four cases of 31 (12.90%) COVID-19 patients were 2019-nCoV RNA positive in saliva, three of which were critically ill. Early diagnosis of 2019-nCoV is still difficult, diagnostic value of saliva specimens for 2019-nCoV nucleic acid examination remains limited but promising, which we should still be cautious but expected about.
公式の確定は喉綿棒によって採取された2019-nCoVのDNAの確認が必要です。喉綿棒は侵襲的で咳や出血などを引き起こす可能性があり、医療従事者の感染リスクを高めます。唾液は呼吸器系の入口であり、2019-nCoVの核酸陽性であることが分かっています。唾液での検体採取は医療従事者の感染リスクを引き下げ患者自身も受け入れやすいと考えられます。
今まで喀出、綿棒、唾液腺開口部から直接採取の3つのアプローチが報告されています。喀出の2つの研究では、12例中11例、23例中20例のCOVID-19罹患者の唾液から2019-nCoVのRNAが検出されました。唾液を綿棒で採取する1つの研究では15例中半分?から検出されました。唾液腺開口部から直接採取した1つの研究では31例(そのうち3例はかなりの重症例)中4例のみ検出されました。
2019-nCoVの早期診断はいまだ困難です。2019-nCoV核酸検査のための唾液の診断価値は未だ限定的ですが有望です。
Deep throat saliva
A study from To et al. showed that deep throat saliva has high diagnosis rate of 2019-nCoV.11 Twelve positive patients were confirmed based on epidemiological history, clinical criteria, and laboratory detection of 2019-nCoV in nasopharyngeal or sputum specimens, and saliva were collected by coughing out a few days after hospitalization.11 Using real-time reverse transcriptionquantitative polymerase chain reaction by testing the S gene of 2019-nCoV, 11 saliva specimens were positive for 2019-nCoV out of 12 patients (91.67%).11 Those 33 patients who are negative for laboratory test of 2019-nCoV were all negative in saliva examination.In addition, six patients offer serial saliva, and five out of them showed a declining trend of virus as hospitalization is going on.11 Live virus was detected in three patients of the above six patients by viral culture.
Another study from the same group used self-collected saliva from deep throat by COVID-19 patients, tested 2019-nCoV RNA, and analyzed temporal profile of 2019-nCoV load.12 From this study, saliva mixed with nasopharyngeal and bronchopulmonary secretions from deep throat was collected by coughing out in the morning. Among 23 COVID-19 patients included for this study, 20 cases of their saliva showed detectable 2019-nCoV RNA.12 In the temporal profile of viral load, saliva reached the peak of viral load during the first week of symptom onset and then declined. This group also detected 2019-nCoV RNA of saliva after treatment.12 Even if using antibodies against 2019-nCoV, viral RNA could still be detected for 20 days or even longer in deep throat saliva specimens of one third of included patients, suggesting the viral RNA could stay a long period of time instead of dying out after antibody application.12 One patient with complete symptom resolved was found 2019-nCoV RNA positive again after 2 days of negative results, suggesting that low levels of 2019-nCoV RNA could still be excreted in saliva even after clinical recovery. More precisely, whether 2019-nCoV RNA detected in saliva after complete symptom resolved means infectious or shedding virus needs further studies to confirm.
報告によると喉の奥からの唾液は高い検出率を示しています。現病歴や診断基準、鼻咽腔または喀痰からの試料採取等でCOVID-19感染が確認された12名の患者において入院数日後の唾液を喀出にて採取しています。RT-PCRにより12例中11例において2019-nCoVが検出されました。鼻咽腔または喀痰からの試料採取等でCOVID-19非検出が確認されている33例に同様な唾液の喀出による検査を行った所全て非検出でした。加えて6例には連続した唾液の採取を行い、そのうち5例は入院を続けている間にウイルスが検出されなくなりました。上記6例のウイルス培養を行い3例にウイルスを確認しました。
上記と同じ被験者を使用し、喉の奥からCOVID-19患者自身が唾液を採取した別の研究もあります。朝に喀出により喉の奥から鼻咽腔、気管支肺の分泌物が混じった唾液を採取しています。23例中20例で2019-nCoV RNAを検出しました。唾液中のウイルス量は症状が発現し消退する最初の週にピークを観察しました。このグループは治療後の唾液中に2019-nCoV RNAが検出されました。たとえ2019-nCoVに対する抗体が作用しても、このグループの1/3において20日、いやそれ以上の期間、喉の奥の唾液中からウイルスのRNAが検出可能でした。これは抗体作用により死滅しても長期間ウイルスのRNAが残存する事を示唆しています。症状が完全に治癒した1人の患者において陰性結果の2日後に再度陽性となりました。これは臨床的に治癒しても少量の2019-nCoV RNAが唾液中に排泄されることを示唆しています。この治癒後の唾液中のRNAの検出が感染性を意味するのかウイルスの排出を意味するのかは今後の研究で確認する必要があります。
Saliva in oral cavity
Oral swabs are probably applicable in early detection. By harvesting oral swabs and testing RNA among 15 COVID-19 patients, Zhang et al. found that half of them (50%) were 2019-nCoV RNA positive in oral swabs, four (26.7%) had positive anal swabs, six (40%) had positive blood test, and three (20%) were serum positive. Dynamic viral RNA presence in saliva compared with anal swabs were analyzed among 16 patients. Among all swab positive together, most of the positive result was from oral swabs at early stage, while more positive came from anal swabs at late stage of COVID-19, suggesting that oral swabs may indicate early infection of 2019-nCoV but cannot be used as a discharge criteria.
唾液を綿棒で採集する方法も早期診断に有効である可能性があります。Zhangらの研究では15人のCOVID-19感染者中、半数の唾液からRNAが検出されました。4名が肛門、6名が血液、3名が血清からもRNAが検出されました。16名の患者において肛門と比較した唾液中のウイルスRNA動態を検討しました。早期には唾液綿棒採取が最も陽性に反応を示し、それよりも遅れて肛門からも検出されるようになりました。これにより唾液の綿棒採取は2019-nCoV感染の早期診断に有効であるが、退院時の診断には有効ではない可能性が示唆されました。
Salivary gland
To rule out contamination of respiratory secretion, Chen et al. collected saliva directly from the opening of salivary gland and found 2019-nCoV nucleic acid, suggesting that salivary glands were 2019-nCoV infected. Thirteen cases who were nucleic acid positive by oropharyngeal swab among 31 COVID-19 patients were included, and four of them (12.90%) were positive in saliva. Three cases of these four were critically ill patents in need of ventilator support, suggesting 2019-nCoV nucleic acid positive in salivary-gland-originated saliva as an indicator of severity of COVID-19.
呼吸系分泌物のコンタミを除外するためにChenらはCOVID-19感染者の唾液腺開口部より直接唾液を採取しました。31名のCOVID-19感染者のうち13例が口腔咽頭部の綿棒採取で核酸陽性でしたが、唾液からは4例のみ陽性となりました。その4例中3例が極めて重症で人工呼吸器が必要でした。これにより唾液腺開口部から採取した唾液で2019-nCoV核酸が検出されることは重症度のインジケーターとして有効である可能性が示唆されました。
POSSIBLE DIRECT INVASIONS INTO ORAL TISSUES
In the cycle of infection for most virus, the first step is to attach to the surface and recognize cell surface receptor of the host cell for invasion. With similar external subdomain of receptor-binding domain (RBD), 2019-nCoV spike share same host-cell receptor—angiotensin-converting enzyme II (ACE2)—with SARS-CoV spike, but in a higher affinity than SARS-CoV spike. In another word, cells expressing cell surface receptor ACE2 are susceptible to 2019-nCoV, similar to SARS-CoV. ACE2 was found expressed in lungs, esophagus, ileum, colon, cholangio of liver, and bladder. Consistently, bronchoalveolar-lavage fluid, nasopharyngeal swabs, stool, and blood of COVID-19 patients were RTPCR- positive for 2019-nCoV. Several studies have shown that salivary gland and tongue express ACE2 receptor, suggesting oral cavity as host for 2019-nCoV to invade.
殆どのウイルス感染のサイクルとして、まず最初のステップは表面のへの吸着と宿主細胞の表面レセプターを認識することです。レセプター結合ドメイン(RBD)の細胞外サブドメインに類似した2019-nCoVコロナウイルススパイクはアンジオテンシン変換酵素2(ACE2)のレセプターをSARS-CoVコロナウイルススパイクと共有します。しかし、2019-nCoVコロナウイルススパイクの方が相性が高いと報告されています。言い換えると、細胞表面にACE2レセプターを発現させている細胞はSARS-CoVと同様に2019-nCoVの影響を受けやすいと言うことです。ACE2は肺、食道、回腸、大腸、胆管、膀胱などに発現しています。
一貫してCOVID-19感染者の気管支肺胞洗浄、鼻咽腔の綿棒、便、血液からRTPCR陽性が確認されています。いくつかの研究から唾液腺と舌にACE2が発現しており、口腔自体が2019-nCoV侵入経路となっている可能性が示唆されています。
Expression of ACE2 in oral tissues
Xu et al. analyzed public bulk RNA-seq from paracarcinoma normal tissues and found expression of ACE2 in oral buccal and gingiva tissue. This group also analyzed data of single-cell RNAseq from patients’ oral tissue and found that ACE2 were highly enriched in epithelial cells of tongue, and also in epithelial cells, T cells, B cells, and fibroblasts of oral mucosa.
Saliva is generated in salivary glands and flow through ducts into oral cavity. Liu et al. analyzed rhesus macaques and found ACE2 were also expressed in epithelial cells lining on minor salivary gland ducts, which could be found in sinonasal cavity, oral cavity, pharynx, larynx, trachea, and lungs, amounting to 800–1000 individuals in total and contributing nearly 1% of saliva a day. This group also set up animal models by inoculating functional pseudovirus intranasally, and found that ACE2+ epithelial cells of minor salivary gland ducts are targeted host cells as early as 48 h after infection.
Besides above evidence from animal study, Chen et al. analyzed data from GTEx, HPA, FANTOM5, and consensus datasets, and revealed the expression of ACE2 receptor in human granular cells in salivary glands. ACE2+ cell in salivary glands could possibly be the target cells of 2019-nCoV and generate infectious saliva in sustained way theoretically.
Xuらは口腔内の正常な頬粘膜と歯肉組織にACE2が発現していることを確認しました。この研究グループはCOVID-19感染者の舌の上皮細胞、口腔粘膜の上皮組織、T細胞、B細胞、線維芽細胞においてACE2が増加している事を報告しています。
唾液は唾液腺で作られ、開口部から口腔内へ流出します。Liuらはアカゲザルにおいて、副鼻腔、口腔、咽頭、喉頭、気管、肺に存在する小唾液線開口部の上皮細胞上にもACE2が発現していることを発見しました。これは小唾液線は800~1000ほど存在しており、1日の唾液量の1%程度を担っています。動物実験においてシェードウイルスを経鼻的に感染させた場合、小唾液線開口部の上皮細胞に存在するACE2発現細胞が感染後48時間程度で標的となると報告されています。
上記結果からChenらはヒト唾液腺顆粒細胞のACE2レセプターが発現することを明らかにしました。唾液腺中のACE2発現細胞は2019-nCoVの標的細胞であり、感染した唾液を作っている可能性があります。
Expression of furin on tongue
Furin has been implicated in virus infection by cleaving viral envelope glycoproteins and enhancing infection with host cells. A furin-like cleavage site in the Spike protein of 2019-nCoV has been identified. Furin is highly expressed in lung tissue, possibly providing a gain-of-function to infectivity of 2019-nCoV. Furin expression was detected by immunostaining in human tongue epithelia, and significantly upregulated when squamous cell carcinoma (SCC) occured. Combined with high expression of ACE2, tongue has high risk of coronavirus infection among oral cavity and SSC even increases the risk once exposed to coronavirus.
While it suggests that cells expressing furin have lower restriction for virus entry theoretically, it should still be cautious whether the furin-like cleavage site plays a big role in 2019-nCoV infection.
フーリン蛋白はウイルスのエンベロープ糖タンパクの分裂と宿主細胞の感染促進によってウイルス感染と関係しています。2019-nCoVスパイク蛋白の中にフーリン嗜好性の切断部位がある事が確認されています。フーリンは肺組織に高発現しており、2019-nCoVの感染性に対する機能獲得を提供している可能性があります。
フーリンは免疫染色することで舌上皮にも発現が確認されており、扁平上皮がんにより有意に増加します。ACE2の高発現と相まって舌は口腔内のコロナウイルス感染の高リスクであり、コロナウイルスに1度暴露するSCC?のリスクは上昇します。
フーリンを発現している細胞はウイルスの侵入に対する防御が弱いことが示唆されている一方で、これが2019-nCoV感染の大きな役割を果たしているかどうかについては慎重であるべきです。
TRANSMISSION OF SALIVA 2019-NCOV
2019-nCoV transmission occurred within indoor space. As noted that 2019-nCoV RNA is detected in saliva, whether 2019-nCoV in saliva could be disseminated by long-distance aerosol transmission is concerned by public. WHO has claimed that droplets generated by an infected people by coughing, sneezing, or talking in close contact is the main routine of 2019-nCoV transmission besides touching contaminated surfaces without washing hands (https://www.who.int/news-room/q-a-detail/q-a-coronaviruses#).
WHO has updated the definition of close contact—any person within 1m with a confirmed case at their symptomatic period,starting from 4 days before symptom onset. However, airborne transmission could also be set up, especially within the same indoor space and aerosol-generating procedure is implemented.
2019-nCoVの感染は室内環境で発生しました。2019-nCoVのRNAは唾液中からも検出され、唾液中の2019-nCoVがエアロゾルによって長距離拡散するかどうかは皆懸念している所です。WHOは近距離で感染者の咳、くしゃみ、会話等で発生する飛沫が、汚れた手で汚染面を触る以外の主な感染経路と主張しています。
WHOは近距離の定義をアップデートして1mとしました。しかしながら、空気感染の可能性もあります。
Size of saliva droplets
Whether droplets can travel long and far along air flow is largely determined by their size. Most communicable respiratory infections are transmitted via large droplets within short distance or by contacting contaminated surfaces. Large droplets (diameter > 60 μm) tend to quickly settle form the air, so the risk of pathogen transmission is limited to individuals in close proximity to the saliva droplet source. Small droplets (diameter ≤ 60 μm) may get involved in short-range transmission (distance between individuals less than 1 m). Small droplets are likely to evaporate into droplet nuclei (diameter < 10 μm) in favorable environment, then become potential for long-distance aerosol transmission.
飛沫はそのサイズにより長距離長時間空気中を漂うかどうかが決まります。最も伝染力のある呼吸器感染症は短距離で大きな飛沫を介するか汚染された表面を触るかで感染します。直径60μm以上の大きな飛沫は大気中で素早く形態を決定する?(固形化して浮遊しないという意味?)傾向があり、かなり近接した唾液飛沫ぐらいしか感染するリスクはないと考えられます。
直径60μm以下の小さい飛沫は1m以内の短距離感染に関与するかもしれません。小さい飛沫の場合は環境によっては蒸発して直径10μm未満の飛沫核になりやすく、エアロゾルによる長距離感染の可能性があります。
Generation of saliva droplets by a person
Saliva droplets are generated when breathing, talking, coughing, or sneezing and formed as particles in a mixture of moisture and droplet nuclei of microorganisms. The amount, distance, and size of saliva droplets varies among people, suggesting the infectious strength and transmission path of saliva droplets differ when same pathogen was contracted. Three thousand saliva droplet nuclei could be generated by one cough, which nearly equals to the amount produced during a 5-min talk. Around 40,000 saliva droplets reaching several meters in air can be generated by one sneeze. One normal exhalation can generate saliva droplets reaching the distance of 1m in air. Large saliva droplets with more mass tends to fall ballistically to the ground and small saliva droplets travel like a cloud over longer distance by air flow.
唾液飛沫は呼吸、会話、咳、くしゃみなどにより発生し、水分と飛沫核が混じった分子として形成されます。量、距離、唾液飛沫のサイズなどは人により異なります。そのため同じウイルスだったとしても感染力や唾液飛沫の感染経路が異なる事が示唆されます。
1回の咳で3000もの唾液飛沫核が発生し、これは5分間の会話とほぼ同じ量です。1回のくしゃみで40000の唾液飛沫が発生し数m到達します。1回の正常な呼気でも1m届く唾液飛沫を発生します。大きな唾液飛沫は弾道的な軌跡で地面に落下し、小さい唾液飛沫は空気の流れにより長い距離を移動します。
Environment-dependent saliva aerosols transmission
Aerosols are suspension of particles in air, liquid, or solid, within size from 0.001 to above 100 μm.39 Infectious aerosols contain pathogens.39 Long-distance aerosol transmission is determined by sufficiently small infectious droplets, being almost indefinitely airborne and transmitted at a long distance (distance between individuals more than 1 m). Aerosol transmission is well accepted in infection of tuberculosis, measles, and chickenpox, and other infectious agents may behave as airborne transmission in a favorable environment or opportunistically, such as SARS-CoV, influenza virus, and adenovirus. Opportunistically airborne transmission is a mode that infectious agents not only have transmission routines by contacting and droplets but also can reach distant susceptible hosts under restricted conditions by fineparticle aerosols in favorable environments. It is possible when aerosol-generating procedure is implemented, such as dental practice, that 2019-nCoV could possibly spread in airborne transmission.
Whether saliva droplets can become truly long-distance aerosol transmission is determined by how long the saliva droplets can reside in the air (physical decay), how long the pathogen in saliva droplets remain infectious (biological decay), and whether theses infectious saliva droplets can be acquired by another person (acquisition).40 In terms of physical decay, saliva droplets evaporate fast into reduced mass in dry air, tending to stay longer along with air flow. The composition of droplet nuclei determines its terminal size. For droplets with slow biological decay, temperature differences and opened door set up droplets exchange along with air flow. Biological decay is determined by dehydration, exposure to ultraviolet and chemicals.39 Only hardy organism such as M.tuberculosis can survive long in air to form long-distance transmission. A recent review summarized that coronavirus stay vital on surfaces of metal, glass, or plastic for up to 9 days, but no solid evidence has been found how long in air. The coronavirus on inanimate surfaces could be efficiently inactivated by 0.1% sodium hypochlorite, 62–71% ethanol, or 0.5% hydrogen peroxide within 1min as summarized in the literature.
So far, no solid evidence to consistently support that 2019-nCoV in saliva droplets can keep vital along air flow for very long time. Liu et al. collected 35 aerosol samples from three areas in two hospitals of Wuhan, and tested 2019-nCoV RNA by droplet digital polymerase chain reaction. They found that patient area had low or even undetectable aerosol 2019-nCoV RNA, but deposition aerosol were tested positive, suggesting that not much vital virus in air flow but tend to deposit to the floor, which is similar to movements of large saliva droplets as noted previously. In medical staff area, airborne 2019-nCoV RNA concentration was decreased after patients reduced and sanitization rigorously implemented. In public area, accumulation of crowds increased airborne 2019-nCoV RNA concentration from undateable level.5
エアロゾルは空気中、液体中、固体中に直径0.001μm~100μmまでのサイズの粒子として存在しています。感染性のエアロゾルは病原性を有しています。長距離のエアロゾル感染は小さい感染性飛沫によって決定されます。この小さい飛沫は殆ど大気にしか見えず1m以上の長距離を伝搬します。エアロゾル感染は結核、麻疹、水痘や、SARS-CoV、インフルエンザ、アデノウイルスなど条件により空中感染のような振る舞いをする感染症でよく認められます。日和見的空気感染は1つの方法です。感染源は接触や飛沫による伝搬のみならず、細かい粒子のエアロゾルが存在する限られた条件下において距離依存性に宿主に到達します。
歯科治療のようにエアロゾルを発生させる機会があれば、2019-nCoVは大気中を拡散する可能性があります。
唾液飛沫が本当に長距離エアロゾル伝搬するかどうかは、唾液飛沫がどれぐらいの期間空中にいて病原性を有しているのか、また他の人が唾液飛沫を取り込む事が可能なのか、ということにより決定されます。物理的崩壊の面では、唾液飛沫は乾燥大気中では早期に蒸発して質量を減少させ、大気の流れに沿って長時間浮遊する傾向があります。飛沫核の組成は末端のサイズを決定します。ゆっくりとした生物学的な崩壊を伴う飛沫のために、気温変化とドアの開放は大気の流れに沿った飛沫変化を起こします。生物学的な崩壊は脱水、紫外線、化学薬品等で決定されます。結核菌のような耐久性が非常に高いものでなければ長距離伝搬は難しいです。最近のレビューでコロナウイルスは金属、ガラス、プラスチックに最大9日間生存すると記載されていますが、大気中ではどれぐらい生存するのかに関しては明確なエビデンスがありません。無生物表面のコロナウイルスは0.1%次亜塩素酸ナトリウム、62-71%エタノール、0.5%過酸化水素で1分以内に不活化することが報告されています。
いまのところ唾液飛沫中の2019-nCoVが長時間大気中で生存しているという確固たるエビデンスはありません。Liuらは武漢の2つの病院の3箇所から35のエアロゾルサンプルを採取して2019-nCoVのRNAが検出されるかテストしました。患者のエリアでは非常に少ない、または検出できないレベルでした。しかし、堆積したエアロゾルでは陽性でした。この結果は大気中にはそれほど多くの生きたウイルスはいないが、フロアに堆積しやすく、これは粒子の大きい唾液飛沫の挙動と類似しています。医療関係者のフロアでは、患者の減少と厳密な消毒の施工後には空気中の2019-nCoV RNA濃度は減少しました。公共のエリアでは群衆の集合によってRNA濃度は増加しました。
Acquisition of infectious saliva aerosols
For acquisition of infectious saliva droplets by a susceptible host,infectious saliva droplets could land in month, eyes, or be inhaled into lungs directly. A case report shows that 2019-nCoV infection occurred in a fever clinic when a susceptible person wore an N95 mask covering mouth and nose without eyes protected, suggesting a transmission to eyes. It is also reported that SARSCoV is predominantly transmitted by contacting eye, mouth, or nose. Respiratory virus could lead to respiratory infections of another person through inducing ocular complications. Exposed mucous membranes increased risk of virus transmission by a SARS-CoV study, and close exposure to an infected person increases the chance of infection. A previous study confirmed that infection of SARS-CoV was reduced to a certain degree by wearing surgical masks of susceptible healthcare workers.
感染性唾液飛沫は口腔周囲、目、または直接的に肺に取り込まれる可能性があります。鼻と口をN95マスクで覆っていたが、眼はガードしていなかった感染者のケースレポートから、眼を介した感染が示唆されます。SARS-CoVも主に眼、口、鼻を介しての感染が報告されています。呼吸器系のウイルスは眼の不調の誘発を通じて他の人に感染を起こします。剥き出しの粘膜は感染リスクを増大させることがSARS-CoVの研究で分かっています。また感染者との近接も感染リスクを増大させます。SARS-CoVの感染は医療従事者のサージカルマスクの装着により減少した事が過去に報告されています。
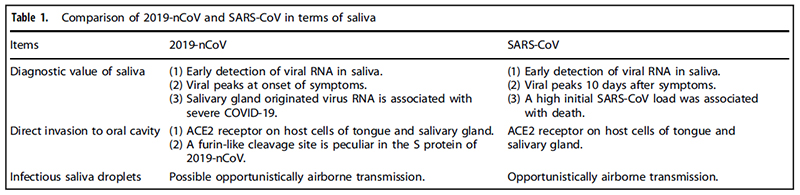
COMPARISON OF SALIVA 2019-NCOV AND SARS-COV
2019-nCoV, which is also named as SARS-CoV-2, shares about 79% nucleotide sequence similarity with SARS-CoV. SARS-CoV have a higher mortality rate, while 2019-nCoV spreads much faster. The similarities and differences of saliva are summarized as follows in terms of diagnosis value of saliva, direct invasion to oral tissues, and saliva droplet transmission between SARS-CoV and 2019-nCoV, hopefully explaining the faster transmission speed of 2019-nCoV (Table 1).
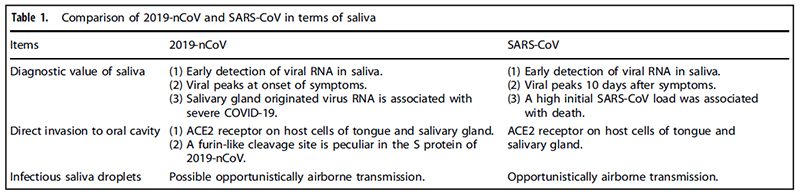
For the diagnostic value of saliva in coronavirus infection, high expression level of SARS-CoV RNA was detected in saliva specimens from 17 SARS patients, four of which had not yet lung lesion, suggesting value of early diagnosis of saliva, similarly to 2019-nCoV. A previous animal study on early events of SARS-CoV infection showed that SARS-CoV was detected in oral swabs before blood test turned positive on second day after viral challenge through nasal cavity.30,63 The viral load profile in saliva of 2019-
nCoV nearly peaks at the time of symptom onset, while SARS-CoV peaks at around 10 days after symptoms.64–67 The high viral load of 2019-nCoV suggests it can be transmitted even if symptom is mild or less obvious. Older age was associated with higher SARS-CoV in saliva, and a high initial SARS-CoV load was associated with death. 2019-nCoV RNA could be detected in saliva for 20 days or even longer, and the prolonged detection of viral RNA also exist in SARS-CoV and MERS-CoV infection.
Despite 2019-nCoV and SARS-CoV share ACE2 receptor on host cells, which are found in salivary gland and tongue tissues, 2019-nCoV is likely more infectious than SARS-CoV possibly due to lower RBD-ACE2 binding free energy and more flexible RBD of 2019-nCoV than that of SARS-CoV. Compared with SARS-CoV, a furin-like cleavage site is peculiar in the S protein of 2019-nCoV, which could theoretically be cleaved by furin expressed in tongue tissues.
For saliva droplets as transmission routine in coronavirus infection, a retrospective cohort study of SARS-CoV transmission reported that students who were in the same cubicle with the SARS patient contracted SARS-CoV, telling us that proximity to SARS patients increases chances of SARS-CoV infection. Virusladen droplets were found in a study as a routine of transmission in SARS epidemics. van Doremalen et al. evaluated the stability of 2019-nCoV and SARS-CoV in aerosils using a Bayesian regression model, and found that 2019-nCoV remained viable ins aerosols throughout 3-h experiment duration, which is similar to SARS-CoV. SARS-CoV dissemination belongs to opportunistically airbornetransmission. 2019-nCoV also possibly belong to the same transmission type, dissemination of virus occurs if individuals are exposed to a high concentration of infectious aerosols in comparatively sealed space for long time.
2019-nCoVは別名SARS-CoV-2とも呼ばれ、SARS-CoVと79%塩基配列が共通しています。SARS-CoVは2019-nCoVよりも高い致死率を有しています。一方で2019-nCoVの拡散スピードはSARS-CoVよりも速いです。SARS-CoVと2019-nCoVの唾液診断、口腔内への直接侵入、唾液飛沫による感染に関する共通性と相違性に関しては表1のように要約されます。これは2019-nCoVの拡散スピードが速いことを説明していると思います。
コロナウイルス感染における唾液の診断では、17名のSARS患者の唾液からSARS-CoVのRNAが高レベルで検出されました。このうち4名は肺領域ではまだ検出されませんでした。これは、2019-nCoVと類似したSARS-CoVの唾液の早期診断の価値を示唆しています。以前の動物実験では、鼻腔からのウイルス感染を試みた2日目に血液からは陰性なのに口腔内の綿棒採取でSARS-CoVが検出されたという報告があります。2019-nCoVの唾液中のウイルス量は症状発現時付近にピークがあります。一方でSARS-CoVは症状発現10日後付近にピークがあります。症状があまり出ていなくても唾液中の高いレベルのウイルス量の検出は2019-nCoVの感染を示唆しています。年齢が高いほど唾液中のSARS-CoVは高レベルになり、初期の高レベルSARS-CoVの検出は死亡と関連します。唾液中の2019-nCoVのRNAは20日以上も検出されます。ウイルスRNAの検出期間が長引く事はSARS-CoVとMERS-CoVでもありました。
2019-nCoVもSARS-CoVも唾液腺や舌の細胞上に認められるACE2レセプターを共通して利用するにも関わらず2019-nCoVの方が感染力が強いのは、RBDとACE2の結合自由エネルギーが強く、フレキシブルなRBDが多い事によるかもしれません。SARS-CoVと比較するとフーリン嗜好性の切断部位は独特で、2019-nCoVのS蛋白で構成されます。これは舌組織の表面に発現したフーリンにより分割されると考えられます。
コロナウイルスの感染経路としての唾液飛沫に関して、SARS-CoV感染の前向きコホート研究によるとSARS患者と同室の学生はSARS-CoVに罹患しました。これはSARS患者との接触はSARS-CoV感染の機会を増加させることを我々に語っています。ウイルスが堆積した飛沫がSARS感染経路として報告されています。van Doremalenらは2019-nCoVとSARS-CoVのaerosil(aerosolの間違い?)中の安定性を評価し、2019-nCoVの方が3時間の実験中エアロゾル中でより生きていた事を報告しています。SARS-CoVの波及は日和見空気感染に属します。2019-nCoVも同様の可能性があります。感染性エアロゾルが高濃度の中に狭い空間に長時間暴露すれば、ウイルスの伝播が起こるかもしれません。
PROSPECTIVE
It seems that the diagnostic value of saliva depends on how saliva specimens are collected. Saliva from deep throat (91.67 and 86.96% corresponding to two studies), from oral cavity(50%), or from salivary glands (12.90%) indicates a diagnostic tendency of decreased positive rate of 2019-nCoV RNA among COVID-19 patients.11–14 For clinical application in need of high positive rate of virus detection, saliva from deep throat has the highest positive rate, which may stand for early diagnosis of COVID-19. Saliva directly from saliva glands ducts is associated with severe COVID-19 and possibly could be a predictive and noninvasive test for severed patients. Whether 2019-nCoV RNA in saliva equals to infectious saliva or a condition of shedding vital virus is still lacking evidence. Even if diagnosis by saliva is noninvasive and less hazardous compared with throat swabs, comprehensive diagnosis should be supported by complete information of symptoms, epidemiological history, and analysis of multiple clinical examinations.
Besides lungs, oral tissue is possible to be directly invaded theoretically due to expression of ACE2 receptor and furin enzyme. About half of the victims reported symptoms of dry mouth and amblygeustia. These symptoms probably came from dysfunction of tongue expressing ACE2 and furin, and salivary gland expression ACE2. However, there is no histopathological evidence to support the direct invasion of 2019-nCoV to oral tissue so far. While it suggests that cells expressing ACE2 and furin have lower restriction for virus entry theoretically, the molecular mechanism of 2019-nCoV infection is not yet fully unfolded and we should still be cautious about and not overstating the current virus-invade-host theory.
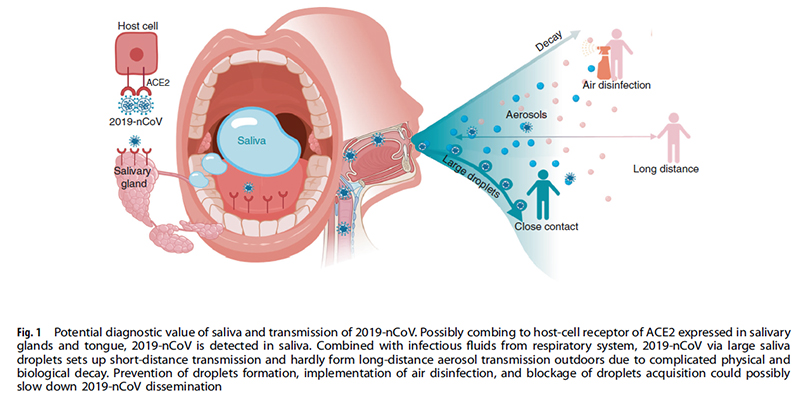
Saliva is a common and transient medium for virus transmission. Among saliva droplets with different sizes generated by breathing, talking, and sneezing, large droplets easily fall onto the floor and only set up short-distance transmission. Saliva could form aerosols and reach a distant host along air flow when in a favorable environment.39 So far, no solid evidence supports that SARS-nCoV or 2019-nCoV can survive in air outdoors for long time to set up long-distance aerosol transmission. Therefore, wearing masks to prevent formation of infectious saliva droplets projecting to the air, thorough disinfection of indoor air to block dissemination of infectious saliva droplets, and keep a distance with people not to acquire infectious saliva droplets could slow down 2019-nCoV epidemic to a certain degree (Fig. 1).
唾液の診断価値は、どこから唾液を採取するかに依存するように思われます。喉の奥の唾液による検出率は2つの研究で91.67%と86.96%であり、口腔内唾液は50%、唾液腺開口部は12.90%でした。臨床応用には高い陽性率が必要であり、喉の奥の唾液が最も高い陽性率でCOVID-19の早期診断に有用かもしれません。唾液腺開口部からの直接採取はCOVID-19の重症度に関連しており、重症患者への侵襲性が低く予知性のある検査の可能性があります。唾液中の2019-nCoVのRNAの存在がそのまま感染性唾液や生きたウイルスの排出状態を意味するかどうかはまだエビデンスがありません。たとえ唾液による診断はのど綿棒よりも非侵襲性で危険が少ないとしても、臨床的な徴候や現病歴などの包括的な診断が必ず必要です。
肺の他に口腔組織もACE2とフーリン酵素の発現によりウイルスが直接侵入する可能性があります。患者の約半数が口腔乾燥と味覚障害を訴えたという報告があります。これらの症状はACE2とフーリンを発現している舌やACE2を発現している唾液腺の機能不全による可能性があります。しかし、いまのところ2019-nCoVが口腔内組織に直接侵入するという事を支持するエビデンスはありません。ACE2とフーリンを発現している細胞はウイルスの侵入が容易になる事は示唆されていますが、2019-nCoVの感染メカニズムは完全に解明されたわけでなく、ウイルス侵入理論を拡大解釈せず慎重になるべきです。
唾液はウイルス感染の一般的な媒体です。異なったサイズが混在する唾液飛沫は呼吸、会話、くしゃみ等で発生します。大きい飛沫はフロアーに容易に落下するので短距離感染のみに関与します。唾液はエアロゾルを形成し恵まれた条件では空気の流れによって長い距離を移動する可能性があります。今までの所、SARS-nCoVと2019-nCoVが空気中で長期間生存しエアロゾルにより長距離感染に関与しているという明確なエビデンスは存在していません。そのため、感染性唾液飛沫の形成を防ぐためにマスクを着用する、感染性唾液飛沫の波及を防ぐために室内を徹底的に消毒する、感染性唾液飛沫を取り込まないように人との距離を取ることは、2019-nCoVの感染拡大をある程度は遅くするかもしれません。
まとめ
唾液による感染診断方法はまだ確立していませんが、可能性はある感じです。
これに関しては今もどんどん論文がでているようなので眼を通していきたいと思っています。
今の所エアロゾルによる長距離感染経路はウイルスが大気中でどれぐらい生存しているかなどがわからないことから確定ではないではないようですが、くしゃみをしても数mは拡散する事からこれぐらいの距離は充分感染距離と考えた方が良さそうです。
口腔内のACE2発現細胞を通じて2019-nCoVが直接侵入するという経路も可能性があります。その際に口渇や味覚異常を感じるというよく知られる臨床症状と理論上一致する事からも可能性は結構ありそうです。
COVID-19関連の論文は数とスピードが凄いので1週間すると古い情報になってしまう可能性もあります。とりあえず自分はまだ何もわかっていなかったのでまず最初の取っかかりとしてレビューを読んでみました。専門外で初めてなのでほぼ全訳しました。ある程度論点は理解できたかなと思います。